

| 充电 |
| 放电 |


科目:高中化学 来源: 题型:
| A、Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B、Na久置于空气中,可以与空气中的有关物质发生反应,最终生成Na2CO3粉末 |
| C、Si、Cl2 均能和烧碱溶液发生氧化还原反应,且都既做氧化剂又做还原剂 |
| D、因为碳酸、氨水能够导电,所以液氨、二氧化碳都为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
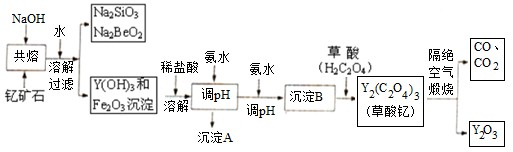
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、b>
| ||
B、b<
| ||
C、b=
| ||
D、b≥
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol/L的醋酸溶液 |
| B、0.01mol/L的CaCl2溶液 |
| C、0.02mol/L的蔗糖溶液 |
| D、0.02mol/L的NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com