
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,3]己烷的结构为![]() ,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
A.![]() 的名称为螺[4,3]辛烷
的名称为螺[4,3]辛烷
B.![]() 的所有碳原子处于一个平面
的所有碳原子处于一个平面
C.螺[2,3]己烷是己烯的同分异构体
D.螺[2,3]己烷加氢可能生成己烷
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)请写出Z-的的离子结构示意图_____________。
(2)请写出Z单质溶于X2Y中发生反应的化学方程式_____________。
(3)请写出Z单质与NaOH反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
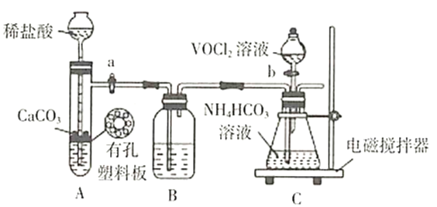
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: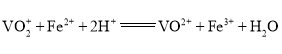 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在铝表面除去氧化膜,物理方法可用_________,化学方法可将其浸入氢氧化钠溶液,发生反应的化学方程式为:_________;
(2)将除去氧化膜的铝迅速用蒸馏水清洗干净,立即插入硝酸汞溶液片刻,发生反应的离子方程式为:__________________;取出铝片用滤纸吸去表面溶液,铝片上出现的“黑斑”是_________;
(3)将此铝放置于空气中,“黑斑”边会长出“白毛”,此物质是_________.
(4)此实验证明了(________)
A.氧化铝都是十分坚硬的晶体 B.铝是较活泼的金属,可以被空气中氧气氧化
C.铝表面的氧化膜有保护作用 D.铝是很不活泼的金属,不可以被氧气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )

A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B. 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C. 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D. 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com