
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
B、向苯酚钠溶液中通入CO2: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
| C、小苏打溶液中加入少量石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| D、NaHS水解反应:HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
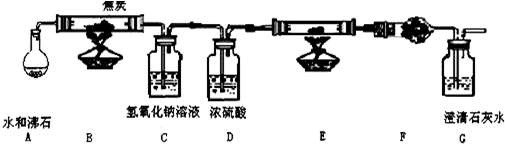
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L液态水分解成2L氢气与1L氧气吸收571.6 kJ热量 |
| B、2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6 kJ |
| C、在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D、使用催化剂能降低该反应的活化能使反应放出得热量小于571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
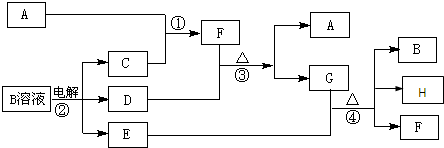
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com