
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
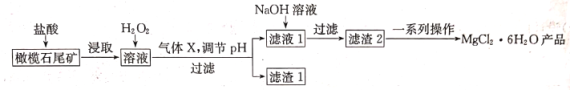
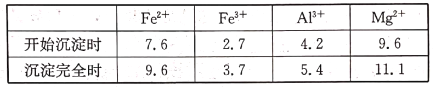
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有______________________(任写两种)。
(2)气体X的电子式为___________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)加入H2O2的目的是___________;若将上述过程中的“H2O2”用“ NaClO”代替也能达到同样目的,则发生反应的离子方程式为_________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过______________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断震荡下,用0.5000mol·L-1的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00mL。
①则产品中MgCl2·6H2O的质量分数为___________(结果保留3位有效数字)。
②下列滴定操作会导致测量结果偏高的是___________(填宇母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数 d滴定管滴定前有气泡,滴定后气泡消失
【答案】将橄榄石尾矿粉碎、增大盐酸浓度、适当提高反应温度等 ![]() +3 将Fe2+氧化为Fe3+ ClO-+2Fe2++2H+=2 Fe3++Cl-+H2O 蒸发浓缩、冷却结晶 96.4% d
+3 将Fe2+氧化为Fe3+ ClO-+2Fe2++2H+=2 Fe3++Cl-+H2O 蒸发浓缩、冷却结晶 96.4% d
【解析】
根据流程:橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)加入盐酸,MgO溶解生成氯化镁,FeO、Fe2O3、Al2O3发生反应生成氯化亚铁、氯化铁、氯化铝,加入过氧化氢氧化亚铁离子生成三价铁离子,通入气体X调节pH,沉淀铁离子生氢氧化铁沉淀,则气体X应为氨气,向滤液中加入过量氢氧化钠溶液,过滤后得到氢氧化镁沉淀,再经过一系列操作得到氯化镁晶体,据此分析解答。
(1)“浸取”步骤中,能加快浸取速率的方法有:将橄榄石尾矿粉碎、增大盐酸浓度、适当提高反应温度等;
故答案为:将橄榄石尾矿粉碎、增大盐酸浓度、适当提高反应温度等;
(2)气体X为氨气,其电子式为![]() ;
;
设铁元素的化合价为x,根据化合价代数和为零有:2x+(-1)n+(-2)×(3-0.5n)=0,解得:x=+3;
故答案为:![]() ;+3;
;+3;
(3)根据以上分析,加入H2O2的目的是将Fe2+氧化为Fe3+;若将上述过程中的“H2O2”用“ NaClO”代替,则发生反应生成Fe3+和Cl-,反应的离子方程式为ClO-+2Fe2++2H+=2 Fe3++Cl-+H2O;
故答案为:将Fe2+氧化为Fe3+ ;ClO-+2Fe2++2H+=2 Fe3++Cl-+H2O;
(4)加入足量盐酸溶解氢氧化镁得到氯化镁溶液,然后经过蒸发浓缩、冷却结晶、过滤、洗涤,即得到氯化镁晶体;
故答案为:蒸发浓缩、冷却结晶;
(5)根据反应Mg2++Y4-=MgY2-,准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,用0.5000mol·L-1的EDTA标准溶液进行滴定,消耗EDTA标准溶液的体积19.00mL。
则Mg2+![]() Y4-,
Y4-,
1 1
0.5000mol·L-1×0.019L n= 0.5000mol·L-1×0.019L=0.0095mol
则产品中MgCl2·6H2O的质量分数=![]() ×100%=96.4%,
×100%=96.4%,
根据c(待测)=![]() 分析不当操作对V(标准)的影响,
分析不当操作对V(标准)的影响,
a.锥形瓶洗涤后没有干燥对测定结果无影响,故A错误;
b.滴定时锥形瓶中有液体溅出导致测定结果偏低,B错误;
c滴定终点时俯视读数,导致标准溶液体积读数偏小,测定结果偏低,故C错误;
d滴定管滴定前有气泡,滴定后气泡消失,读取标准溶液的体积增大,导致测定结果偏高,所以d选项是正确的。
故答案为:96.4%;d。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)19 g 某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是________;ACl2的化学式是________。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,则下列说法错误的是
2CO32-+6H2O,则下列说法错误的是
A. 放电时CH3OH参与反应的电极为正极
B. 充电时电解质溶液的pH逐渐增大
C. 放电时负极的电极反应式为:CH3OH-6e-+8OH-=CO32—+6H2O
D. 充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A(含有苯环的烃,化学式C8H8)和CCl4为原料合成苯丙氨酸E的流程如下:
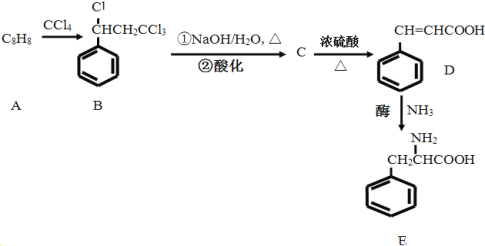
已知:烃分子中的氢原子被卤素原子取代所生成的衍生物叫做卤代烃,如CH3CH2Cl;卤代烃在NaOH水溶液加热条件下会水解,如:
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
 (该反应不需要条件就迅速转化)
(该反应不需要条件就迅速转化)
R-CH2CH2OH![]() R-CH=CH2+H2O
R-CH=CH2+H2O
(1)D→E的反应类型为_____________________。
(2)A的结构简式为________________________。
(3)有关D的叙述错误的是___________(填序号)。
a.能使酸性KMnO4溶液褪色 b.能与溴的CCl4溶液反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C→D反应的化学方程式为___________________________________。
(5)满足下列条件的E的同分异构体共有_________种。
①属于酯类;②苯环上只有两个对位取代基,其中一个为—NH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为___________________________。以氯化铬晶体制备无水氯化铬的方法是_________________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):
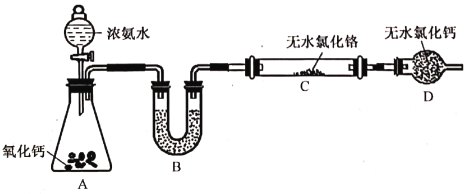
①装置A中发生反应的化学方程式为____________________________________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是______________________。
③装置B中盛放的试剂是___________,装置D的作用是______________________。
④有同学认为该装置有一个缺陷,该缺陷是______________________。
(3)氮化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为___________。
(4)工业上也可用Cr2O3与NH3在高温下反应制备CrN。相关反应的化学方程式为___________,提出一条能降低粗产品中氧含量的措施:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如下图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是( )
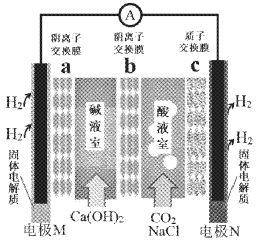
A. 电子由M极经外电路流向N极
B. N电极区的电极反应式为2H++2e-=H2↑
C. 在碱液室可以生成 NaHCO3、Na2CO3
D. 放电一段时间后,酸液室溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com