
【题目】活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min内,用NO表示该反应的平均速率v(NO)=molL﹣1min﹣1 .
(2)该反应的化学方程式是 .
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是 , 电极反应式为:;
②b处电极反应式为;
③电池工作时H+由极移向极(填正、负极).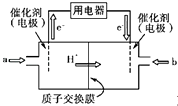
【答案】
(1)0.03
(2)C+2NO?N2+CO2
(3)②④
(4)CH3OH;CH3OH﹣6e﹣+H2O=CO2+6H+;3O2+12e﹣+12H+=6H2O;负;正
【解析】解:(1.)2min时一氧化氮物质的量变化为:0.100mol﹣0.040mol=0.060mol,2分钟内,用NO表示该反应的平均速率v(NO)= ![]() =0.03molL﹣1min﹣1 , 所以答案是:0.03;
=0.03molL﹣1min﹣1 , 所以答案是:0.03;
(2.)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2 , 且该反应为可逆反应,故反应方程式为:C+2NON2+CO2 , 所以答案是:C+2NON2+CO2;
(3.)C+2NON2+CO2 , ①速率之比等于化学方程式计量数之比为正反应速率之比,v(NO):v(A):v(B)=2:1:1,不能说明 正逆反应速率相同,不能证明反应达到平衡状态,故①错误;②气体质量反应前后发生变化,体积不变,混合气体的密度不变,能说明反应达到平衡状态,故②正确;③反应前后气体物质的量不变化,当总压强不再改变,不能说明反应达到平衡状态,故③错误; ④反应前后气体质量变化,气体物质的量不变,当反应混合气体的平均相对分子质量不再改变说明反应达到平衡状态,故④正确;所以答案是:②④;
(4.)氢离子移动方向可知通入a的电极为负极,通入的气体为甲醇,甲醇失电子生成二氧化碳,结合电荷守恒和原子守恒写出电极反应,通入b的电极为正极,通入的是氧气得到电子在酸性溶液中生成水,①a电极通入的是甲醇,负极发生的电极反应为:CH3OH﹣6e﹣+H2O=CO2+6H+ , 所以答案是:CH3OH;CH3OH﹣6e﹣+H2O=CO2+6H+;②b处通入的氧气是在正极得到电子酸性溶液中生成水,电极反应为:3O2+12e﹣+12H+=6H2O,所以答案是:3O2+12e﹣+12H+=6H2O;所以答案是:3O2+12e﹣+12H+=6H2O;③原电池中阳离子从负极移向正极,所以答案是:负;正;
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在t1时达到平衡:A(g)+B(g) ![]() xC(g)+D(s),在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s),在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. t1~t3间该反应的平衡常数相同,均为0.25 B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质D D. 反应方程式中x=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,只用试管和胶头滴管无法鉴别的是( )
A.Al2(SO4)3和NaOH
B.Na2CO3和盐酸
C.NaCl和AgNO3
D.盐酸、NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分数)与pH的关系如下图所示。下列叙述不正确的是( )
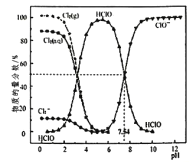
A. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断变浅
B. 新制的pH=l的氯水中,c(H+)>c(Cl3-)>c(HClO)
C. 25℃时,HC1O![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为Cl2+2OH-=ClO-+C1-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下三组溶液:①植物油和水 ②氯化钠和单质碘的水溶液 ③40%的乙醇溶液,分离以上混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后A2O82-离子变为AO42-离子,又知反应中氧化剂和还原剂的物质的量之比为2︰1,Mn2+离子被氧化后Mn元素的化合价为
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)在密闭容器中充入一定量的H2S,发生反应2H2S(g)![]() 2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
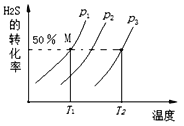
①该反应的ΔH__________0(填“>”、“=”或“<”);
②图中压强(p1、p2、p3)由小到大的顺序为_____________________;
③图中M点的平衡常数KP=_______________(KP是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)羰基硫(COS)是一种粮食熏蒸剂,能有效防止粮食被某些昆虫、线虫和真菌危害。在2 L的密闭容器中,保持温度T不变,将CO和H2S混合,并达下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
①若达平衡时n(H2S)=5mol,a 为_______。平衡时CO的转化率为________。
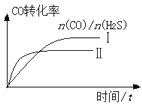
②曲线Ⅰ和Ⅱ表示该温度下,CO和H2S投料比[n(CO)/ n(H2S)]不同时,CO转化率随时间变化图像。则曲线Ⅰ和Ⅱ中a值的大小关系为:Ⅰ___Ⅱ(填“大于”“等于”“小于”),理由是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com