
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
分析 元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱.
解答 解:将少量氯水滴入NaBr溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现NaBr溶液分层,上层接近无色,下层溶液呈橙红色,说明氯气将溴离子氧化生成溴单质,离子反应方程式为Cl2+2Br-=2 Cl-+Br2;
将少量氯水滴入KI溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现KI溶液分层,上层接近无色,下层溶液呈紫色,说明氯气将碘离子氧化生成碘单质;
将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置,上层接近无色,溶液分层且下层为紫红色,说明溴将碘离子氧化生成碘单质,离子方程式为Br2+2I-=2 Br-+I2,
①中氧化剂是Cl2、氧化产物是Br2,②中氧化剂是Cl2、氧化产物的I2,③中氧化剂是Br2、氧化产物是I2,
所以氧化性强弱顺序是Cl2>Br2>I2,元素的非金属性越强,其单质的氧化性越强,所以非金属性强弱顺序是Cl>Br>I,
故答案为:
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 无色,橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 | |
| 无色,紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 | |
| 无色,紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
点评 本题以卤素单质之间的置换反应为载体考查同一主族元素性质递变规律,明确非金属性强弱与其单质氧化性强弱关系是解本题关键,易错点是化学用语正确运用,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U的中子数为235 | |
| B. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是两种核素,它们互称为同素异形体 | |
| C. | 核反应属于化学变化 | |
| D. | 合理利用核能符合“低碳经济”要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | Ca(OH)2═Ca2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .(2分)
.(2分)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | A | B | C |
发 生 装 置 | 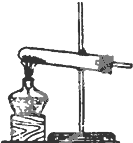 |  | 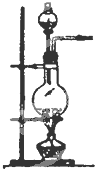 |
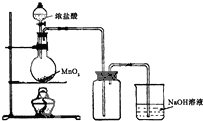
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
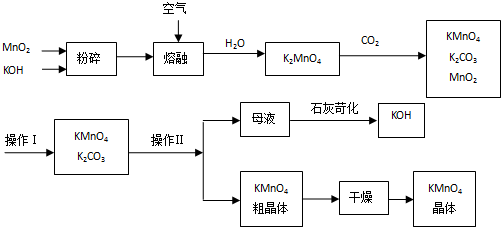
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com