
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为___(填代号)。
a.KMnO4b.(NH4) 2S c.H2O2d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、_________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是_____。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)__________(填化学式),若实验过程中有氨气逸出,应选用下列_____装置回收(填代号)。

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应______________________,直到______________________________,用KMnO4标准溶液滴定时应选用___滴定管(填“酸式”或“碱式”)。
【答案】c d 冷却结晶 引流 NH3·H2O b 平视凹液面(或平视刻度线) 凹液面的最低点与刻度线相切 酸式
【解析】
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+,由于亚铁离子沉淀时的pH值大于沉淀铜离子时的pH值,所以需要加入氧化剂氧化亚铁离子。由于不能引入新的杂质,所以应该加入双氧水,答案选c。铁离子能与KSCN溶液反应使溶液显红色,则检验溶液A中Fe3+的最佳试剂为KSCN溶液,答案选d。
(2)硫酸铜易溶于水,则由溶液C获得CuSO4·5H2O,需要经过加热蒸发、冷却结晶、过滤、洗涤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器是玻璃棒,该仪器在此操作中的主要作用是引流。
(3)CO2与氯化钙不反应,因此要制备CaCO3,应向CaCl2溶液中先通入氨气,使溶液显碱性,然后再通入CO2。氨气极易溶于水,吸收氨气需要防止倒吸,因此导管不能插入到溶液中,可以用倒置的漏斗来防止倒吸,所以若实验过程中有氨气逸出,应选用b装置回收。
(4)定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切。高锰酸钾溶液具有强氧化性,能腐蚀橡胶,应该用酸式滴定管。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】(1)工业上用CO2和H2反应合成二甲醚,反应的热化学方程式为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的n(CO2)/n(H2)值变小
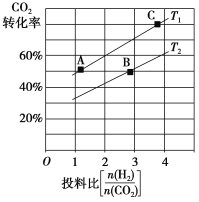
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者的大小关系是_____________。
③上述合成二甲醚的过程中,提高CO2的转化率可采取的措施有_______________ (任写两种)。
(2)用氨水吸收CO2可得到NH4HCO3溶液。若常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,在NH4HCO3溶液中,c(NH4+)________c(HCO3-)(填“>”、“<”或“=”),试计算常温下反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
(3)绿色“二甲醚燃料电池”在酸性溶液中负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:
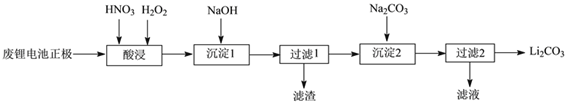
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式_________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是_________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)尼泊金酯(![]() )是国际上公认的广谱高效食品防腐剂,是国家允许使用的食品添加剂。下列对尼泊金酯的判断不正确的是__________(填选项序号)。
)是国际上公认的广谱高效食品防腐剂,是国家允许使用的食品添加剂。下列对尼泊金酯的判断不正确的是__________(填选项序号)。
a. 能发生水解反应
b. 能与FeCl3溶液发生显色反应
c. 分子中所有原子都在同一平面上
d. 与浓溴水反应时,1mol尼泊金酯消耗1molBr2
(2)写出“间甲基苯乙烯”的结构简式:__________。
(3)写出“苯酚钠中通入少量的二氧化碳”的化学方程式:__________。
Ⅱ.已知某反应为:
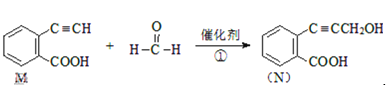 。
。
(4)M分子中官能团名称__________。
(5)1mol M完全燃烧需要__________ molO2。
(6)有机物N不可发生的反应为______。
A.氧化反应 B.取代反应 C.消去反应 D.还原反应 E.加成反应
(7)物质N与H2反应生成的P(结构简式为![]() )发生缩聚反应产物的结构简式为_____________________。
)发生缩聚反应产物的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:

(1)写出生成A的化学方程式__________________;
(2)写出苯和液溴反应生成E的化学方程式________;其反应类型为____________。
(3)C的结构简式为___________;由B生成C的反应类型为____________。
(4)乳酸(![]() )生成六元环酯的化学方程式:__________
)生成六元环酯的化学方程式:__________
(5)乙酸苯酚酯(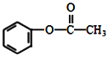 )在热的NaOH溶液中反应的化学方程式:__________
)在热的NaOH溶液中反应的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
A.25°C时,饱和![]() 溶液与饱和
溶液与饱和![]() 溶液相比,前者的
溶液相比,前者的![]() 大
大
B.25°C时,在![]() 的悬浊液加入少量的
的悬浊液加入少量的![]() 固体,
固体,![]() 增大
增大
C.25°C时,![]() 固体在20ml0.01 mol·
固体在20ml0.01 mol·![]() 氨水中的
氨水中的![]() 比在20mL0.01mol·
比在20mL0.01mol·![]()
![]() 溶液中的
溶液中的![]() 小
小
D.25°C时,在![]() 的悬浊液加入
的悬浊液加入![]() 溶液后,
溶液后,![]() 不可能转化成为
不可能转化成为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g) ![]() x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com