
��һ���¶��½�2 mol A��2 mol B������������2 L�ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() 2C(g)��2D(g)��2����ĩ��Ӧ�ﵽƽ��״̬��������0.8 mol D������д����հס�
2C(g)��2D(g)��2����ĩ��Ӧ�ﵽƽ��״̬��������0.8 mol D������д����հס�
(1)��D��ʾ��ƽ����Ӧ����Ϊ_____ _ ___�� A��ת����Ϊ______ ____��
(2)�����С�����ݻ�(�¶Ȳ���)����ƽ����ϵ�л��������ܶ�_________(����������١����䡱)��
(3)����ʼʱֻ��C��D��4/3 mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ����ȣ���Ӧ����____ mol B���ʡ�
(4)����ԭƽ����ϵ��Ͷ��1 mol A��1 mol B��ƽ��__________(����ơ����ƻ��ơ�)��
 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺
��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺ M
M M
M�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 72V |
| a |
| 72V |
| 2000m |
| MV |
| 2000m |
| MV |
| 100m |
| Vp |
| 100m |
| Vp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
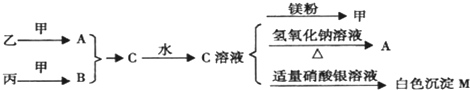
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��1mol O2������������Ӧ����ˮ��������483.6kJ����1gˮ����ת����Һ̬ˮ����2.444kJ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
��1��1mol O2������������Ӧ����ˮ��������483.6kJ����1gˮ����ת����Һ̬ˮ����2.444kJ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com