
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.铁离子能够将碘离子氧化成碘单质;
B.二氧化硅能够与强氧化钠溶液反应生成硅酸钠和水;
C.氢氧化钙过量,铵根离子和碳酸氢根离子都采用反应,且反应生成碳酸钙沉淀;
D.双氧水被酸性高锰酸钾溶液氧化成氧气.
解答 解:A.二者发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A错误;
B.盛放烧碱的试剂瓶不能用玻璃塞,原因是二氧化硅与强氧化钠溶液发生反应生成硅酸钠,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,故B正确;
C.向碳酸氢铵溶液中加过量石灰水并加热,反应生成氨气、碳酸钙沉淀和水,正确的离子反应为:Ca2++HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CaCO3↓,故C错误;
D.用酸化的高锰酸钾溶液氧化双氧水的离子反应为:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O,故D正确;
故选BD.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应是解答本题的关键,注意熟练掌握离子方程式的书写原则,试题培养了学生灵活应用能力.


科目:高中化学 来源: 题型:解答题
 .(其它无机物任选)
.(其它无机物任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸式滴定管量取20.0mL酸性高锰酸钾溶液 | |
| B. | 用米汤直接检验食盐中是否有碘元素 | |
| C. | 用酚酞检验纯碱中是否含有烧碱 | |
| D. | 多次盐析或多次渗析的方法分离提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为铁,负极为铜,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
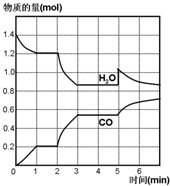 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
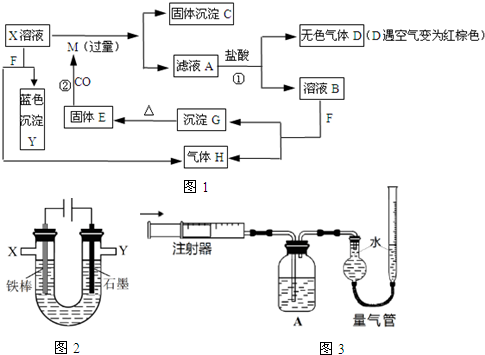
 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱反应 | B. | 强酸与强碱反应 | ||
| C. | 一元强酸和一元碱反应 | D. | 强酸与强碱反应生成水和可溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$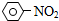 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com