
【题目】利用周期表中同主族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有______个未成对电子,白磷的分子式为P4,其结构如图甲所示。科学家目前合成了N4 分子,N 原子的杂化轨道类型是______,N-N 键的键角为_____;N4分解后能产生N2并释放出大量能量,推测其用途为____________。

(2)N、P、As 原子的第一电离能由大到小的顺序为___________。
(3)立方氮化硼晶体的结构如图乙所示。该晶体中,B原子填充在N原子的______(填空间构型名称)空隙中,且占据此类空隙的比例为________(填百分数)。

(4)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为____g·cm-3(用含a 的式子表示,设NA为阿伏加德罗常数的值)。
【答案】 3 sp3 60° 制造火箭推进剂或炸药 N>P>As (正)四面体 50% 氮化硼 ![]()
【解析】(1)P元素原子价电子排布式为![]() ,基态原子有3个未成对电子,
,基态原子有3个未成对电子,![]() 分子与
分子与![]() 结构相似,为正四面体构型,
结构相似,为正四面体构型,![]() 分子中N原子形成3个
分子中N原子形成3个![]() 键、含有1对孤对电子,杂化轨道数目为4,N原子采取
键、含有1对孤对电子,杂化轨道数目为4,N原子采取![]() 杂化,每个面为正三角形,
杂化,每个面为正三角形,![]() 键的键角为
键的键角为![]() ;
;![]() 分解后能产生
分解后能产生![]() 并释放出大量能量,可以制造火箭推进剂或炸药,因此,本题正确答案是:3;
并释放出大量能量,可以制造火箭推进剂或炸药,因此,本题正确答案是:3;![]() ;
;![]() ;制造火箭推进剂或炸药;
;制造火箭推进剂或炸药;
(2)同主族自上而下第一电离能减小,故第一电离能:![]() ,
,
因此,本题正确答案是:![]() ;
;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子,B原子占据此类空隙的比例为![]() ,
,
因此,本题正确答案是:正四面体;![]() ;
;
(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径![]() 、
、![]() ,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为
,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为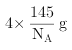 ,晶胞密度为
,晶胞密度为 ,
,
因此,本题正确答案是:氮化硼; .
.
点睛:本题考查物质结构与性质相关知识, (2)同主族自上而下第一电离能减小;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子;(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径越小,共价键越强,晶体熔点越高;根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据![]() 计算晶胞密度.
计算晶胞密度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知H2X为二元弱酸,常温下,0.1 mol/L的NaHX溶液中c(H+) > c(OH-),下列关系中一定正确的是
A. c(Na+) + c(H+) = c(HX-) + 2c(X2-) B. c(H+)·c(OH-) = 10-14 mol2·L-2
C. c(Na+) = c(X2-) + c(HX-) D. 溶液中pH = 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。通过查阅资料,学习小组获知:FeCl3是一种共价化合物,熔点306℃,沸点315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)现象i中的白雾是___________________,形成白雾的原因是________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有_______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
原因①:实验b检出的气体使之变蓝,反应的离子方程式是______________________________。
原因②:在酸性条件下,装置中的空气使之变蓝,反应的离子方程式是_______________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试荆是____________________。
②方案2中检验Fe2+的试剂是____________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是_____________________。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,物质的量最大的是__________,含分子个数最多的是________,含原子个数最多的是_________,质量最大的是__________(填字母)。
A.6g氢气 B.0.5molCO2 C.1.204×1023个CO分子 D.147g H2SO4 E.92g乙醇(C2H5OH)
(2)NA表示阿伏加德罗常数的值
①1.204×1023个水分子中共________mol氢原子。
②某气体在同温同压下对H2相对密度为32,则该气体的相对分子质量为__________。
③某气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是___g/mol。
④25g CuSO4·5H2O晶体中含有氧原子______个。
⑤16gO2含有的氧分子数与______g CO2含有的氧原子数相等。
⑥标准状况下,11.2 L CH4中含有的氢原子数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
(1)该反应的逆反应是________热反应,且m+n______(填“>”“<”或“=”)p。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. 金刚石和石墨互为同位素
B. C2H6和C5H12互为同系物
C. C2H4和C2H6互为同系物
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷。下列有关丙烷的叙述不正确的是
A.分子中碳原子不在一条直线上B.光照下能够发生氯代反应
C.比丁烷更易液化D.分子中碳-碳原子间是非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)试用质子数、中子数、电子数、质量数和同位素填空:
①![]() 与
与![]() 具有相同的_____
具有相同的_____
②![]() 与
与![]() 互为_____
互为_____
(2)同温同压下,相同质量的 H2 和 N2 中分子数目之比为_____
(3)将标况下 22.4L 的 HCl溶于水配成 200mL 溶液,所得溶液的物质的量浓度为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com