

| A. | 有机物A不能使溴的四氯化碳溶液褪色 | |
| B. | 胡妥油可以发生加成反应和氧化反应 | |
| C. | 有机物A与胡妥油互为同系物 | |
| D. | 1 mol胡妥油完全燃烧消耗313.6 L的氧气 |
科目:高中化学 来源: 题型:选择题
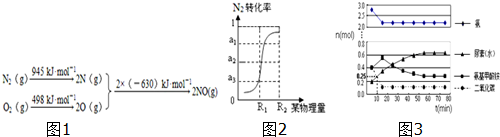
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、CH3COO-、K+、SO42- | |
| B. | 在含较多Al3+的溶液中:Na+、Cl-、HCO3- | |
| C. | 在0.1 mol•L-1 CaCl2溶液中:K+、Ba2+、I-、OH- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

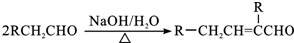
 .
.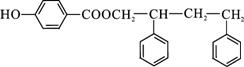 .
.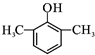 或
或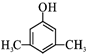 (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
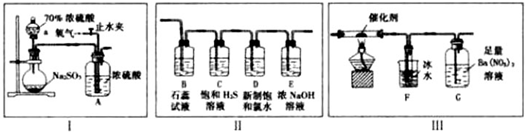
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 异丁烯与环丁烷互为同分异构体 | |
| B. | 聚异丁烯的结构简式可表示为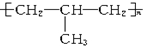 | |
| C. | 异丁烯可与氯化氢反应制得2-甲基-2-氯丙烷 | |
| D. | 聚异丁烯能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2能使FeCl3、KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 冷的浓硫酸和浓硝酸可以用铁桶装 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com