
| A、标准状况下,2.24LSO3中含有氧原子数目为0.3NA |
| B、0.1 molCl2全部溶于水后转移电子数目为0.1 NA |
| C、只有在标准状况下,NA个 O2所占的体积才是22.4L |
| D、6.0g甲酸甲酯和正丙醇的混合物中含甲基数目为0.1 NA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
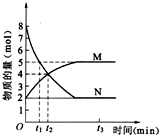 化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示:
化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | ||||
B、用惰性电极电解NaHS溶液:HS-+H2O
| ||||
| C、向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4++Fe2++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3.H2O | ||||
| D、明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C、向0.0008 mol?L-1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com