
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 及时将CO2和N2从反应体系中移走
C. 升高温度同时充入N2 D. 增大压强同时加催化剂
科目:高中化学 来源: 题型:
【题目】滴定是一种重要的定量实验方法:
Ⅰ.酸碱中和滴定:常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
(1)滴定盐酸的曲线是图__________(填“1”或“2”)
(2)滴定前CH3COOH的电离度为__________
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”)
Ⅱ.氧化还原滴定原理与中和滴定原理相似,为了测定某NaHSO3固体的纯度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)准确量取一定体积的酸性KMnO4溶液需要使用的仪器是___________________。
(2)已知酸性KMnO4溶液的还原产物为MnSO4,写出此反应的离子方程式:_____
(3)若准确称取WgNaHSO3固体溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。则滴定终点的现象为_______NaHSO3固体的纯度为_________。
(4)下列操作会导致测定结果偏低的是__________.
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶未干燥
C 盛装酸性KMnO4溶液的滴定管,滴定前滴定管尖嘴部分有气泡, 滴定后无气泡
D 不小心将少量酸性KMnO4溶液滴在锥形瓶外
E 观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 若2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B. 若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和,放出28.7kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2的一种工艺流程如下:
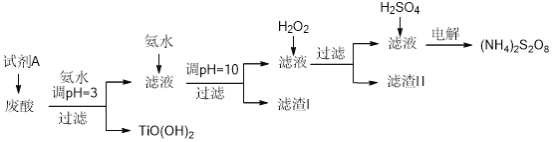
已知:i.
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)试剂A为__________,其作用是____________。
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色。焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质可能是__________(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有__________(填化学式)。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++_____+4H2O+H2O2=______+4NH3·H2O
(5)过二硫酸铵中硫元素的化合价为__________。
(6)常温下,含硫微粒主要存在形式与 pH的关系如下图所示。
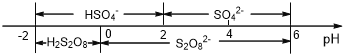
用惰性电极电解饱和NH4HSO4溶液制备过二硫酸铵时,在阳极放电的离子主要为HSO4-,则阳极区电解质溶液的pH范围为____<pH<____,其电极反应式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知很多气体都能用来做喷泉实验,若在同温同压下两个等体积烧瓶,一个收集满![]() 和
和![]() 的混合气体,另一个收集满
的混合气体,另一个收集满![]() ,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(
,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(![]() )和溶质的质量分数(
)和溶质的质量分数(![]() )关系是(两烧瓶所得溶液密度几乎相等)
)关系是(两烧瓶所得溶液密度几乎相等)
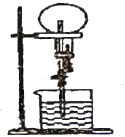
A. ![]() 和
和![]() 都不同 B.
都不同 B. ![]() 和
和![]() 都相同
都相同
C. ![]() 相同,
相同,![]() 不同 D.
不同 D. ![]() 相同,
相同,![]() 不同
不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com