
分析 (1)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,根据m=nM计算碳酸钠质量;
(2)反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据钙离子物质的量计算二氧化碳的物质的量,结合二氧化碳的体积分数计算碳酸化尾气的体积.
解答 解:(1)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,m(Na2CO3)=nM=98mol×106g/mol=10388g,故答案为:10388;
(2)加入的碳酸钠除钙离子,溶液中n(Ca2+)=n(Na2CO3)=98mol,反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据Ca2++2NH3+CO2+H2O→CaCO3↓+2NH4+,可知需要二氧化碳为98mol,故需要碳酸化尾气的体积为98mol×22.4L/mol÷0.04=54880L,
故答案为:54880.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 可用“丁达尔现象”区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | BaCl2是一种离子晶体,其在熔融状态下可以导电 | |
| C. | 欲从碘水中得到碘单质,可用酒精做萃取剂 | |
| D. | 欲从KNO3溶液中得到KNO3晶体,可用蒸发结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
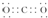 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )
25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )| A. | c点时,c(Na+)=c(CH3COO-) | |
| B. | b点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | d点时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 从a点到c点间可能有:c(CH3COO-)>c(H+)=c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3•H2O | |
| D. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
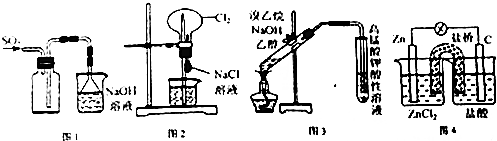
| A. | 用图1装置可以收集SO2 | |
| B. | 用图2装置可以完成“喷泉”实验 | |
| C. | 用图3装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| D. | 用图4装置可以实现化学反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 吲哚不能使溴的四氯化碳溶液褪色 | |
| B. | 苯甲醛可发生加成、氧化和还原反应 | |
| C. | 可用银氨溶液鉴别苯甲醛和中间体 | |
| D. | 该中间体分子中含有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤 | |
| B. | KNO3固体中混有少量NaCl:加H2O配制热的饱和溶液,再冷却结晶、过滤 | |
| C. | 乙醇中的少量水:加入适量新制的生石灰,加热蒸馏 | |
| D. | 二氧化碳中混有少量一氧化碳:点燃除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
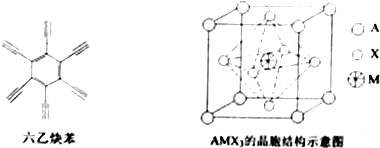
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com