
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
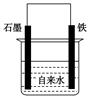
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 装置 | 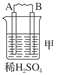 |  |  |
| 现象 | 二价金属A 不断溶解 | C的质量 增加 | A上有气 体产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
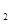 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是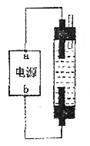
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极'b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题: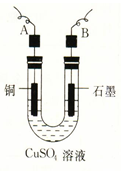
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
D.电解后烘干称重的操作中必须按“烘干→称量 →再烘干→再称量”进行; →再烘干→再称量”进行; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H+ + 2e- = H2↑ | B.Fe2+ + 2e- =" Fe" |
| C.2H2O + O2 + 4e- = 4OH- | D.Fe3+ + e- = Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
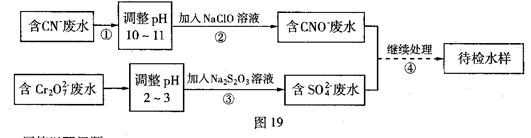
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com