
分析 (1)①依据烃燃烧的通式400K时,生成的水为气态,根据烃燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用气体体积差量计算;
②135℃,101.3kPa时水为气体,设烃为CxHy,由CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用气体体积差量确定y值,然后结合a=8L时1.5(x+$\frac{y}{4}$)≤10,据此确定该烃的分子式;
③烃的分子式为C7H8,烃完全燃烧,则满足1.5(x+$\frac{y}{4}$)≤a,据此计算.
(1)根据烃A分子中碳的质量分数,计算分子中C原子、H原子数目,写出A的分子式;由于A、B的最简式相同,再结合烃B式量比空气的平均式量稍小,推断B的分子式;
(2)A的核磁共振氢谱中有四个吸收峰,据此确定A的结构简式为A为 ,并命名;A的核磁共振氢谱中有二个吸收峰,则A 的结构简式可能为CH3CH=CHCH3,CH2=C(CH3)2;
,并命名;A的核磁共振氢谱中有二个吸收峰,则A 的结构简式可能为CH3CH=CHCH3,CH2=C(CH3)2;
(3)A分子中含碳碳双键,采用sp2杂化,A分子又中含碳碳单键,采用sp3杂化;其中单键为σ键,双键中含有1个σ键与1个π键;非金属元素形成的物质是分子晶体;极性分子的熔沸点大于非极性分子的熔沸点;
解答 解:Ⅰ①设烃的分子式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O~气体体积差量△V=$\frac{y}{4}$-1
1 $\frac{y}{4}-1$
1.5 (a+3-a-1.5)
解得:y=8;
即该烃的分子式为:CxH8子中氢原子数为8,
故答案为:分子中氢原子数为8;
②若a=8时,由于该烃完全燃烧,则:1.5(x+$\frac{y}{4}$)≤10,解得:x≤$\frac{14}{3}$,x可能为3或4,
则该烃的分子式可能为C4H8或C3H8,
故答案为:C4H8或C3H8;
③当该烃的分子式为C7H8时,烃完全燃烧1.5(x+$\frac{y}{4}$)≤a,解得a≥13.5,
故答案为:a≥13.5;
Ⅱ(1)由于碳元素的质量分数为85.7%,所以烃A中C原子的数目为$\frac{56×86%}{12}$=4,所以烃A中H原子的数目为$\frac{56-12×4}{1}$=8,所以烃A的分子式为C4H8;
A、B的最简式相同,最简式为CH2,B式量比空气的平均式量稍小,最简式CH2,所以B的分子式为C2H4,
故答案为:C4H8;C2H4;
(2)A的核磁共振氢谱中有四个吸收峰,据此确定A的结构简式为A为 ,故命名为1-丁烯;A的核磁共振氢谱中有二个吸收峰,则A 的结构简式可能为CH3CH=CHCH3,CH2=C(CH3)2,
,故命名为1-丁烯;A的核磁共振氢谱中有二个吸收峰,则A 的结构简式可能为CH3CH=CHCH3,CH2=C(CH3)2,
故答案为:1-丁烯;CH3CH=CHCH3; CH2=C(CH3)2;
(3)A分子中含碳碳双键,采用sp2杂化,A分子又中含碳碳单键,故又采用sp3杂化,故杂化方式有sp2和 sp3;其中单键为σ键,双键中含有1个σ键与1个π键,故1个A分子中含有的σ键与π键的个数比为11:1;A中所含的元素是非金属元素,非金属元素形成的物质是分子晶体,故A的固体形成的晶体属于,分子晶体;极性分子的熔沸点大于非极性分子的熔沸点,A为极性分子,B为非极性分子,故熔沸点A>B,
故答案为:sp2和 sp3; 11:1;分子晶体,>.
点评 本题(1)主要考查烃燃烧的有关计算,难度中等,注意利用烃燃烧的通式,结合差量法进行解答,注意水是气态,侧重学生分析计算能力的综合考查.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题

| A. | A 与金属钠完全反应时,两者物质的量之比为 1:3 | |
| B. | A 与氢氧化钠完全反应时,两者物质的量之比为 1:1 | |
| C. | A 能与碳酸钠溶液反应 | |
| D. | A 既能与羧酸反应,又能与醇反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
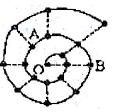 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | A、B组成的化合物中不可能含有共价键 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | 离O点越远的元素原子半径越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Fe3+溶液中:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积大 | |
| C. | 一定温度下,反应2Mg(S)+CO2(g)=2MgO(S)+C(s)能自发进行,则该反应△H<0 | |
| D. | 常温时,0.1mol•L-l CHCOOH 溶液加水稀释,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-丙醇 | B. | 2-丁醇 | C. | 1-戊醇 | D. | 2-甲基-2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com