
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2 , 也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101 kPa,温度为0℃).
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 .
A.200mL
B.400mL
C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为: .
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是 .
(4)若在烧瓶中投入d g锌,再加入VL c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 ![]() =(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,
=(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管, ![]() 的比值将(填偏大、偏小或无影响)
的比值将(填偏大、偏小或无影响)
【答案】
(1)C
(2)Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
(3)![]() =
= ![]() +
+ ![]()
(4)![]() ,偏小
,偏小
【解析】解:(1)
Zn+H2SO4=ZnSO4+ | H2↑ |
1mol | 22.4L |
![]() =0.02mol 0.448L
=0.02mol 0.448L
0.448L=448mL,则量气管的规格应该选500mL,
所以答案是:C; (2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,与氢氧化钠增重的质量一致,故发生反应的化学方程式为:Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O,
ZnSO4+SO2↑+2H2O,
所以答案是:Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O;(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气,都是1mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等可得:
ZnSO4+SO2↑+2H2O;(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气,都是1mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等可得: ![]() =
= ![]() +
+ ![]() ,
,
所以答案是: ![]() =
= ![]() +
+ ![]() ;(4)
;(4)
Zn+ | 2H2SO4(浓)=ZnSO4+ | SO2↑+2H2O |
2mol | 1mol | |
|
|
则生成二氧化硫需要的硫酸为 ![]() mol;
mol;
Zn+ | H2SO4=ZnSO4+ | H2↑ |
1mol | 1mol | |
( cV﹣ | (cV﹣ |
则: ![]() =
= 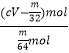 =
= ![]() ;
;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
所以答案是: ![]() ;偏小.
;偏小.


科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3 , 不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),流程如图: 
(1)滤渣Ⅰ的主要成分是(填化学式).
(2)还原时,试剂X若选用SO2 , 则反应后的阴离子是(填化学式).
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是、、过滤、洗涤、干燥.
(4)七水合硫酸亚铁(FeSO47H2O) 在医学上常用作补血剂.某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量. 步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4﹣+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL.
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要、 .
②该补血剂中亚铁离子的含量为mg/片 (请写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
(1)利用△H﹣T△S判断,该反应在条件下自发进行(填“高温”“低温”、或“任何温度”).
(2)计算500℃时该反应的平衡常数K= . CO 的平衡转化率为 .
(3)下列措施可增大甲醇产率的是 . A.压缩容器体积 B.将CO(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(4)可判断可逆反应达到平衡状态的依据是 . A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.容器中CO、H2、CH3OH的物质的量之比为1:2:1
E.混合气体压强不再随时间变化而变化
(5)若其它条件不变,使反应在300℃下进行,在上图中作出甲醇的物质的量浓度随时间的变化的示意图. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2﹣氯丙烷制得少量的CH3CHOHCH2OH,需要经过下列几步反应( )
A.消去→加成→取代
B.加成→消去→取代
C.取代→消去→加成
D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KBr和KI的混合溶液中通入过量的Cl2充分反应后,将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是( )
A.KCl和KIB.KBrC.KClD.KCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示: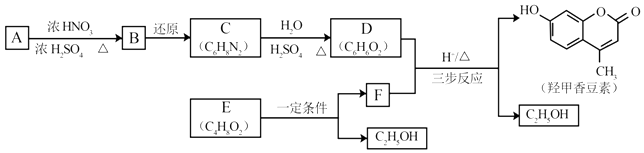
已知: 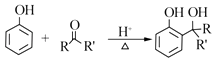
RCOOR'+R'OH ![]() RCOOR'+R'OH(R、R'、R'代表烃基)
RCOOR'+R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是 . B中所含的官能团是 .
(2)C→D的反应类型是 .
(3)E属于脂类.仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式: .
(4)已知:2E ![]() F+C2H5OH.F所含官能团有
F+C2H5OH.F所含官能团有 ![]() 和 .
和 .
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F.
(2)气体发生装置中进行的反应化学方程式是;当0.5mol MnO2参与反应时,被氧化的HCl的质量为 , 生成的Cl2在标准状况下的体积约为 .
(3)在装置中:①饱和食盐水的作用是 , ②浓硫酸的作用是 .
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉﹣KI试纸.如果有Cl2产生,可观察到的现象是 , 写出反应方程式 .
(5)写出尾气吸收装置中进行的反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示: 
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 .
(2)滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com