
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -a kJ/mol
②CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H= -b kJ/mol
③H2O (g)= H2O(l) △H= -c kJ/mol
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)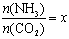 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。

下例说法正确的是
(A)NH3的平衡转化率随着x增大而增大,上图中的B点处,NH3的平衡转化率为32%
(B)上图中的D点处,未达到平衡状态,且v(正) < v(逆)
(C)当反应体系中H2O的质量不再改变时,反应达到平衡状态
(3)关于电化学的研究:
Na2FeO4和Zn可以组成碱性电池,其反应的离子方程式为:
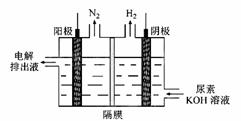
2FeO42- + 3Zn + 8H2O = 3Zn(OH)2+ 2Fe (OH)3+4 OH-,请写出放电时正极的电极反应式 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。当高铁电池中有3.32g Na2FeO4放电时,电解尿素[CO(NH2)2]的碱性溶液的阴阳两极共收集的气体体积为 mL(标准状况下)。
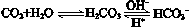 (4)关于电离平衡的研究:
(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
①正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射 缓解(填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
科目:高中化学 来源: 题型:
能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2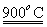 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所述变化规律正确的是( )
A.Na、Mg、Al还原性依次增强 B.HCl、PH3、H2S稳定性依次减弱
C.NaOH、KOH、CsOH碱性依次增强 D.S2-、Cl-、K+、Ca2+离子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华” ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A. ①②④⑥⑦ B. ④⑥ C.①④⑤⑧ D.①②④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.在FeI2溶液中滴入几滴稀溴水:Fe2+ + Br2 = 2Fe3+ + 2Br-
B. FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2- ═2Fe2++S↓
C.在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3- + OH- = SO32- + H2O
D.等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂:
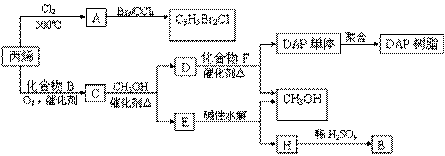
已知酯与醇可发生如下酯交换反应:
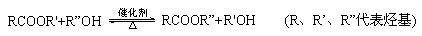
(1)农药分子C3H5Br2Cl中每个碳原子上均连有卤原子。
①A的结构简式是 ,A含有的官能团名称是 ;
②由丙烯生成A的反应类型是 。
(2)A水解可得到D,该水解反应的化学方程式是 。 (3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是 。
(4)下列说法正确的是(选填序号字母) 。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是 。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液能够区别SO2和CO2气体的是 ( )
①澄清的石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
①]直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____________________________
________________________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO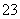 )∶n(HSO
)∶n(HSO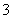 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶ | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态烃和溴水发生加成反应生成2,3-二溴-2-甲基丁烷,则该烃是( )
A. 3-甲基-1-丁烯 B. 2-甲基-2-丁烯 C. 2-甲基-1-丁烯 D.1-甲基-2-丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com