
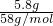 =0.1mol,根据Mg元素守恒可知,m(Mg)=0.1mol×24g/mol=2.4g,
=0.1mol,根据Mg元素守恒可知,m(Mg)=0.1mol×24g/mol=2.4g,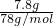 =0.1mol,根据Al元素守恒可知,m(Al)=0.1mol×27g/mol=2.7g,
=0.1mol,根据Al元素守恒可知,m(Al)=0.1mol×27g/mol=2.7g,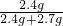 ×100%=47.1%,
×100%=47.1%,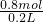 =4mol/L,
=4mol/L, 计算二者的物质的量,根据Mg元素,Al元素守恒,计算镁和铝的物质的量,进而计算镁和铝的质量,利用质量分数定义计算;
计算二者的物质的量,根据Mg元素,Al元素守恒,计算镁和铝的物质的量,进而计算镁和铝的质量,利用质量分数定义计算; 计算氢氧化钾的浓度.
计算氢氧化钾的浓度.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原来混合物中镁和铝的质量分数;
(2)所用KOH的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的镁、铝混合粉末,加入1 mol·L-1的硫酸300 mL,使之完全溶解(酸过量);再加入过量的未知浓度的KOH溶液200 mL,得到5.8 g沉淀;过滤后向滤液中加入2 mol·L-1盐酸100 mL,恰好沉淀完全;将沉淀滤出,洗涤、干燥,称量为7.8 g。求:
(1)原来混合物中镁和铝的质量分数;
(2)所用KOH的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市松江二中高二(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com