
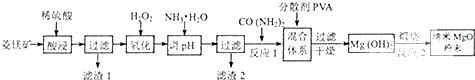
分析 以菱铁矿(主要成分为MgCO3,含少量FeCO3、SiO2)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤渣1为SiO2,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH沉淀铁离子,过滤得到滤渣为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,加入CO(NH2)2至开始产生沉淀,加入PVA过滤干燥得到氢氧化镁沉淀,高温煅烧制备高纯氧化镁,
(1)过氧化氢氧化亚铁离子为铁离子,易于除去不会引入新的杂质;
(2)上述分析可知煅烧滤渣2为氢氧化铁制得的金属氧化物是氢氧化铁分解生成的氧化铁,灼烧固体需要在坩埚中灼烧;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨;
(4)依据溶度积计算得到;
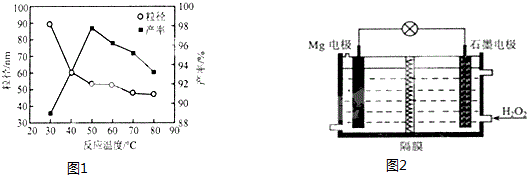
(5)图象分析可知在50°C时氧化镁产率最大;
(6)该原电池中,镁作负极,石墨做正极,正极上双氧水得电子生成氢氧根离子;
解答 解:(1)过氧化氢时绿色氧化剂,氧化亚铁离子不会引入新的杂质,氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)煅烧滤渣2为氢氧化铁制得的金属氧化物是氢氧化铁分解生成的氧化铁,化学式为Fe2O3,灼烧固体需要在坩埚中灼烧,需要的仪器除酒精灯、三脚架以外,还需要坩埚、泥三角;
故答案为:Fe2O3,②③;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;
故答案为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;
(4)已知25℃,Ksp[Mg(OH)2]=1.8×10-11),25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$=10-4mol/L,Ksp=c(Mg2+)c2(OH-)=1.8×10-11,c(Mg2+)=$\frac{1.8×1{0}^{-11}}{(1{0}^{-4})^{2}}$=1.8×10-3mol/L;
故答案为:1.8×10-3;
(5)图1为反应温度对纳米MgO产率和粒径的影响,据图分析50°C时氧化镁产率最大,反应的最佳温度为
50°C,
故答案为:50° C;
(6)该原电池中,镁作负极,正极上双氧水得电子生成氢氧根离子,电极反应式为H2O2+2e-=2OH-,
故答案为:H2O2+2e-=2OH-.
点评 本题考查了物质分离方法和提纯过程分析判断,原电池原理和电极反应书写,溶度积常数的计算分析,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: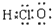 | |
| D. | NaCl的电子式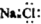 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
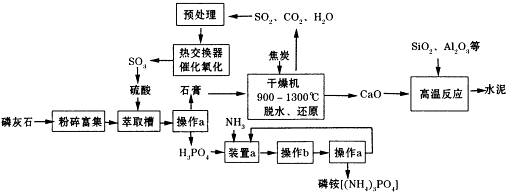
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
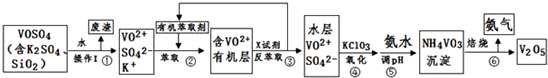
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
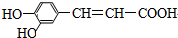
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
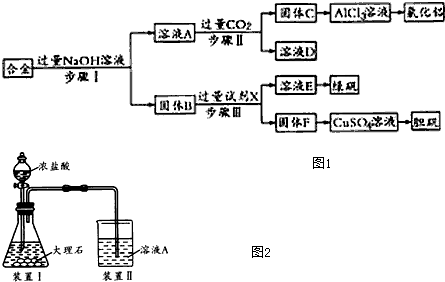
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com