
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
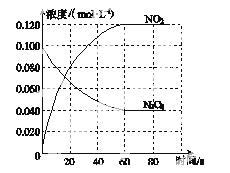
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是__________________ __________。
__________。
②列式计算温度T时反应的平衡常数K2:_______________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
科目:高中化学 来源: 题型:
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定容积的密闭容器中充入3 mol A和1 mol B,发生反应:3A(g)+B(g) xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.9 mol A、0.3 mol B和2.1 mol C作为起始物质,达到平衡后,C的体积分数仍为w%,则x值可能为( )
xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.9 mol A、0.3 mol B和2.1 mol C作为起始物质,达到平衡后,C的体积分数仍为w%,则x值可能为( )
A.1 B.2
C.3 D.任意值
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯甲酸乙酯在OH-存在 下发生水解反应:
下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反 应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180 s与180~240 s 区间的平均反应速率________、________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________(要求写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )。
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果的是 ( )。
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1) (1)已知AX3的熔点 和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX
AX 5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
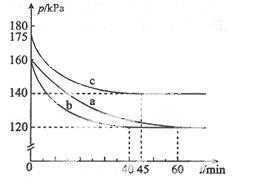
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
 ;实验a和c的平衡转化率:αa为 、αc为 。
;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在①MgO、CuO、CaO、SO2;②C、Fe、S、P;③ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质在分类上与组内其他物质不同,这三种物质分别是( )
A.CuO、Fe、ZnCl2 B. SO2 、Fe、HNO3 C. CaO、C、BaCO3 D. SO2 、S、NaNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com