
【题目】室温时将100mLH2S和O2的混合气体,点燃完全反应后恢复到原来状况,体积变为40mL。下列叙述中正确的是( )
A.剩余40mL气体一定是O2
B.剩余40mL气体是H2S或SO2
C.混合气体中含H2S40mL或80mL
D.剩余40mL气体是SO2和O2混合气体
【答案】BC
【解析】
H2S和O2的混合气体点燃,氧气不足量时发生反应①2H2S+O2═2S↓+2H2O,氧气足量时发生反应②2H2S+3O2═2SO2+2H2O。若n(H2S):n(O2)≥2:1,发生反应①,H2S刚好完全反应或有剩余;若n(H2S):n(O2)≤2:3,发生反应②,氧气可能有剩余,气体为二氧化硫(可能含有氧气);若2:3<n(H2S) :n(O2)<2:1,发生反应①②,气体为二氧化硫。
A.若O2有剩余,则剩余40mL气体一定含有SO2,A不合题意;
B.若剩余40mL气体是H2S,则参加反应的H2S、O2为60mL,且只发生反应①2H2S+O2═2S↓+2H2O;若剩余40mL气体是SO2,则参加反应的H2S、O2为100mL,且只发生反应②2H2S+3O2═2SO2+2H2O,V(H2S)=![]() ×100mL=40mL=V(SO2),B符合题意;
×100mL=40mL=V(SO2),B符合题意;
C.若混合气体中含H2S40mL,则含O260mL,刚好发生反应②2H2S+3O2═2SO2+2H2O,生成V(SO2)=40mL;若混合气体中含H2S 80mL,则含O220mL,只发生反应①2H2S+O2═2S↓+2H2O,消耗H2S40mL,剩余40mL,C符合题意;
D.剩余40mL气体是SO2和O2混合气体,设剩余O2的体积为x,则生成SO2的体积为40-x,参加反应的H2S、O2为100-x,只发生反应②2H2S+3O2═2SO2+2H2O,V(H2S)=![]() ×(100-x),依据SO2的体积相等可得:
×(100-x),依据SO2的体积相等可得:![]() ×(100-x)=40-x,x=0,D 不合题意;
×(100-x)=40-x,x=0,D 不合题意;
故选BC。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.恒容密闭容器中进行的反应3A(g)![]() B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大
B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大
B.对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.反应NH3(g)+HCl(g)=NH4Cl(s)△H<0在任何条件下均能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2 (g)的平衡物质的量浓度c (CO2)与温度T 的关系如图所示。下列说法错误的是

A.反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)为吸热反应
CO2(g)+H2(g)为吸热反应
B.在T2时,若反应处于状态D,则一定有υ正>υ逆
C.平衡状态A 与C 相-比,平衡状态A 的c(CO)大
D.若T1、T2 时的平衡常数分别为K1、K2则K1> K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
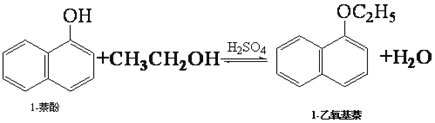
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是________。
(2)装置中长玻璃管的作用是:______________。
(3)该反应能否用实验室制备乙酸乙酯的装置_____(选填“能”或“不能”),简述理由_____________。
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是____________(选填编号)。

a.③②④① b.①②③④ c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是____________。

(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下:
![]()
完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],反应的化学方程式为___。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:Mg(OH)2-xClxmH2O→(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJmol-1
Al(OH)3(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)-87.7kJmol-1
H2O(g)-87.7kJmol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是___。等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是___,原因是___。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):___
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭容器中发生反应Mg)N(g),反应过程中的能量变化如图中曲线所示,下列说法错误的是

A.该反应正反应活化能为E3-E2
B.该反应的△H=E1-E2
C.曲线Ⅱ表示其他条件不变,升高温度时的能量变化
D.曲线Ⅲ表示其他条件不变,加入催化剂时的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com