
| A. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| B. | 含重金属离子的电镀废液不能随意排放 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | Si3N4是一种新型无机非金属材料,可应用于制造发动机 |
分析 A.白色污染是人们对难降解的聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓;聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染;
B.重金属离子有毒;
C.根据造成雾霾天气的原因判断;
D.氮化硅是原子晶体,硬度很大,耐磨耐高温.
解答 解:A.聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故A错误;
B.重金属离子有毒,含重金属离子的电镀废液不能随意排放,故B正确;
C.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故C正确;
D.氮化硅是原子晶体,硬度很大,耐磨耐高温,所以可以制造发动机,它是一种新型无机非金属材料,故D正确.
故选A.
点评 本题考查了常见生活环境的污染与治理、金属的腐蚀与防护、塑料的老化与降解等问题,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=2﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 产物B的状态只能为固态或液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
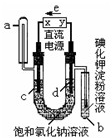 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )| A. | 在电解开始时,a管中有无色气体生成 | |
| B. | x极为阴性 | |
| C. | 在电解开始后,在c极附近颜色变红 | |
| D. | 通电一段时间后,混合液颜色可能变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>C | B. | 原子序数C>B>A | ||
| C. | 单质的还原性A>B>C | D. | 离子半径C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
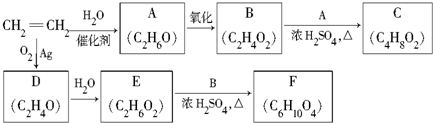
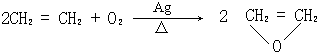 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com