
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
分析 A、根据铅蓄电池的工作原理来回答;
B、加水稀释促进电离,铵根离子浓度增大,一水合氨浓度减小,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值增大;
C、碳酸氢根离子是弱离子在水溶液里存在水解平衡和电离平衡;
D、碳酸钙分解属于吸热反应,△H>0,CaCO3(s)═CaO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发判断.
解答 解:A、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故A错误;
B、加水稀释促进电离,铵根离子浓度增大,一水合氨浓度减小,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值增大,故B错误;
C、碳酸氢根离子是多元弱酸的酸式根离子,弱离子在水溶液里存在水解平衡和电离平衡,故C正确;
D、碳酸钙分解属于吸热反应,△H>0,CaCO3(s)═CaO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,在高温条件下△G=△H-T•△S<0反应自发进行,低温时不自发,故D错误;
故选C.
点评 本题综合考查学生原电池和电解池的工作原理知识、化学反应进行的方向,能够根据化学方程式准确判断出焓变和熵变,然后根据△G=△H-T•△S<0自发判断温度即可.


科目:高中化学 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,②
,② 中氯原子较难水解.
中氯原子较难水解. 或
或 .
. .
.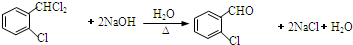 .
. .
. .
. ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气与氯气反应后,体系的能量降低 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 若生成物的总能量高于反应物的总能量,则反应过程吸收能量 | |
| D. | 化学反应的实质是旧化学键的断裂和新化学键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 600℃时,上述方程式中a=160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含1.2 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少炭的量 | B. | 保持体积不变,增加水蒸气的量 | ||
| C. | 将容器体积缩小一半 | D. | 保持压强不变,充入Ne |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com