
 -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH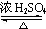 ��CH3��2CHCOOCH2CH2CH2-
��CH3��2CHCOOCH2CH2CH2- +H2O
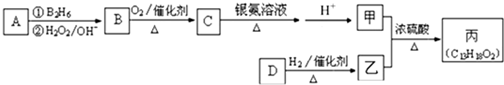
+H2O���� ����Է�������ͨ���������Ϊ88�����ĺ˴Ź���������ʾֻ������壬�����պ��㴼��Ϊͬϵ���Ϊ������Ϊ���ᣬ���Ϊ2-�����ᣬ��Ϻϳ�ת��ͼ�еķ�Ӧ������֪��AΪ2-����ϩ��BΪ2-��������CΪ2-����ȩ�������ҷ�Ӧ�������ɱ���C13H18O2��������ΪC9H12O����1molD��2mol������Ӧ�����ң�����DΪC9H8O��Ȼ�������ʵĽṹ�����������
��� �⣺����Է�������ͨ���������Ϊ88�����ĺ˴Ź���������ʾֻ������壬�����պ��㴼��Ϊͬϵ���Ϊ������Ϊ���ᣬ���Ϊ2-�����ᣬ��Ϻϳ�ת��ͼ�еķ�Ӧ������֪��AΪ2-����ϩ��BΪ2-��������CΪ2-����ȩ�������ҷ�Ӧ�������ɱ���C13H18O2��������ΪC9H12O����D��������Ӧ�����ң�����DΪC9H10O��
��1��������������֪��AΪ2-����ϩ�������ϩ����
�ʴ�Ϊ��2-����ϩ��
��2��C������Cu��OH��2����Һ��Ӧ�Ļ�ѧ����ʽΪ ��CH3��2CHCHO+2Ag��NH3��2OH$\stackrel{��}{��}$��CH3��2CHCOONH4+2Ag��+3NH3��+H2O��
�ʴ�Ϊ����CH3��2CHCHO+2Ag��NH3��2OH$\stackrel{��}{��}$��CH3��2CHCOONH4+2Ag��+3NH3��+H2O��
��3�������ҷ�Ӧ�������ɱ���C13H18O2�������к�������-CH3���ڴ���������1molD��2molH2���Է�Ӧ�����ң�D�в�����������DΪ -CH=CHCHO��
-CH=CHCHO��
�ʴ�Ϊ�� -CH=CHCHO��
-CH=CHCHO��
��4�������ҷ�����������Ӧ�Ļ�ѧ����ʽΪ��CH3��2CHCOOH+ -CH2CH2CH2OH
-CH2CH2CH2OH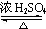 ��CH3��2CHCOOCH2CH2CH2-
��CH3��2CHCOOCH2CH2CH2- +H2O��
+H2O��
�ʴ�Ϊ����CH3��2CHCOOH+ -CH2CH2CH2OH
-CH2CH2CH2OH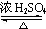 ��CH3��2CHCOOCH2CH2CH2-
��CH3��2CHCOOCH2CH2CH2- +H2O��
+H2O��
��5��DΪC9H10O�����������ٱ����ϵ�һԪȡ������4�֣�˵�����������������ڼ�λ��ȡ���������������ԣ�˵���з��ǻ��������������D��ͬ���칹��Ϊ�����ļ�λ������-OH��-CH=CHCH3����-OH��-CH2CH=CH2����-OH��-C��CH3��=CH2 ����3 �֣�
�ʴ�Ϊ��3��
���� ���⿼���л�����ƶϣ���ȷ�л���Ľṹ�仯��̼���������ŵı仯�ƶϸ������ǽ����Ĺؼ�����Ŀ�ѶȽϴ��ۺ��Խ�ǿ��


 ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӻ�������һ���������Ӽ� | |
| B�� | ���ʷ����о������ڻ�ѧ�� | |
| C�� | ȫ���ɷǽ���Ԫ���γɵĻ������в����ܺ������Ӽ� | |
| D�� | ���й��ۼ��Ļ�����һ���ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ����������ˮ | B�� | ͨ�����������Ը��������Һ | ||
| C�� | �ڵ��ܿڵ�ȼ | D�� | һ����������H2��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������������Һ������ˮ | B�� | �����ȷ�ұ�������� | ||
| C�� | ����֬�Ʒ��� | D�� | ��ˮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢ڢ� | C�� | �٢ڢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 CO2 ��CO�����ǵ����������ϵ�൱���У�ij��ѧ������Դ˽�����̽����
CO2 ��CO�����ǵ����������ϵ�൱���У�ij��ѧ������Դ˽�����̽�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ĸ�C-H����ȫ��ͬ | B�� | CH4��һ�ȴ���ֻ��һ�� | ||
| C�� | CH2Cl2ֻ��һ�ֿռ�ṹ | D�� | �ڳ��³�ѹ��CH2Cl2ΪҺ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1}{9a}$ mol-1 | B�� | 9a mol-1 | C�� | 2a mol-1 | D�� | 18a mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com