
下列实验现象预测正确的是()

A. 实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明
B. 实验Ⅱ:蔗糖变黑,且高锰酸钾溶液变无色
C. 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:当液体至红褐色,停止加热,让光束通过液体时可产生丁达尔现象
考点: 化学实验方案的评价;胶体的重要性质;硝酸的化学性质;氮的氧化物的性质及其对环境的影响;铁的化学性质.
专题: 实验评价题.
分析: A.苯与水互不相溶;
B.根据浓硫酸具有脱水性和氧化性的性质分析;
C.广口瓶内有空气,可与NO反应;
D.制备氢氧化铁胶体可在沸水中滴加饱和氯化铁溶液.
解答: 解:A.单质溴能与NaOH溶液发生氧化还原反应,所以振荡后静置,上层溶液颜色会逐渐消失,苯不溶于水,溶液分层,故A错误;
B.浓硫酸具有脱水性和强氧化性,浓硫酸首先将蔗糖脱水生成单质碳,然后单质碳被浓硫酸氧化而被还原成SO2,SO2具有还原性可是酸性KMnO4溶液褪色,故B正确;
C.在加热时稀硝酸与铜发生氧化还原反应,硝酸被还原成NO,NO在空气被氧化生成NO2,NO2是红棕色气体,故C错误;
D.装置Ⅳ属于氢氧化铁胶体的制备,而胶体具有丁达尔效应,故D正确.
故选BD.
点评: 本题考查化学实验的评价,题目难度不大,注意把握相关物质的性质,为解答该类题目的关键,易错点为B,注意浓硫酸的性质.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
一定条件下,对于含有一定数目分子的气体,决定其体积的主要因素是( )
A.气体分子间的平均距离 B.气体的分子的形状
C.气体分子本身的大小 D.气体分子的种类
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用Na2SO3还原MnO4﹣,如果还原含有2.4×10﹣3 mol MnO4﹣的溶液时,消耗30mL0.2mol•L﹣1的Na2SO3溶液,则Mn元素在还原产物中化合价为( )
|
| A. | +1 | B. | +2 | C. | +4 | D. | +5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有三种物质AC2、B2C2、AD4,第二周期元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)A、B的元素名称分别为 、 .
(2)AD4分子其中含有的化学键类型为 键(选填“极性”或“非极性”).
(3)D的负一价阴离子的电子排布式为 ,B2C2的电子式为 ,属 (填“离子化合物”或“共价化合物”).
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)⇌MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是()
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
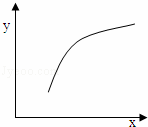
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42﹣.电池放电时,负极的电极反应为:V2+﹣e﹣=V3+.
①电池放电时的总反应方程式为 .充电时,电极M应接电源的 极.
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+) (填“增大”、“不变”或“减小”),
阳极的电极反应式为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是( )
|
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3;3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是 ,第一电离能最小的元素是.
(2)基态氮原子的L层电子排布图为 .
(3)与N3﹣互为等电子体的分子为 (写出一种).依据价层电子对互斥理论,NO3﹣的空间构型为 .
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为 .叠氮化钠的水溶液呈碱性,用离子方程式表示其原因: .
(5)N2O沸点(﹣88.49℃)比NH3沸点(﹣33.34℃)低,其主要原因是 .
(6)安全气囊的设计原理为6NaN3+Fe2O3 3Na2O+2Fe+9N2↑.
3Na2O+2Fe+9N2↑.
①氮分子中σ键和π键数目之比为 .
②铁晶体中存在的化学键类型为 .
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为 3 (用含a、NA的表达式表示,其中NA为阿伏加德罗常数).
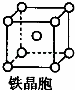
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com