
【题目】过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A。
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来。
③进行如图所示操作,得到固体C,洗涤,干燥。

④称量得固体C的质量为2.87 g。
(1)沉淀剂B为________(填化学式)。
(2)向A中加入稀HNO3酸化的目的是_______________________。
(3)如何洗涤固体C: __________________。如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数________(填“偏大”“偏小”或“不变”)。
(4)该样品中氯元素的质量分数为________________。
【答案】AgNO3 除去溶液中的CO32- 沿玻璃棒向过滤器中注入少量蒸馏水,使水刚好浸没沉淀,让水自然流下,重复2~3次 偏大 0.71%
【解析】
操作步骤中:①将100g样品溶于水得到A,A为含有氯化钠的碳酸钠溶液;
②向A中加入稀HNO3酸化后,硝酸和碳酸钠反应生成硝酸钠和二氧化碳、水,然后加入过量沉淀剂B,使Cl-完全沉淀下来,氯离子和银离子反应生成AgCl沉淀,则沉淀剂B为AgNO3溶液;
③进行过滤操作,分离难溶性固体AgCl和溶液,C为AgCl,然后将沉淀洗涤,干燥的纯净AgCl固体;
④称量得固体AgCl的质量为2.87g;
根据反应过程中根据Cl原子守恒得n(Cl-)=n(AgCl),所以由AgCl的量计算氯元素质量,从而确定氯离子质量分数。
操作步骤中:
(1)根据上述分析可知沉淀剂B是AgNO3溶液;
(2)A溶液中含有NaCl、Na2CO3,向其中加入稀HNO3,发生反应:Na2CO3+2HNO3=2NaNO3+CO2↑+H2O,达到除去溶液中的CO32-离子的目的;
(3)沉淀C是AgCl,洗涤沉淀的方法是沿玻璃棒向过滤器中注入少量蒸馏水,使水刚好浸没沉淀,让水自然流下,重复2~3次;
(4)根据Cl原子守恒得n(Cl-)=n(AgCl),n(AgCl)=![]() =0.02mol,则m(Cl-)=0.02mol×35.5g/mol=0.71g,故Cl元素质量分数=
=0.02mol,则m(Cl-)=0.02mol×35.5g/mol=0.71g,故Cl元素质量分数=![]() ×100%=0.71%。
×100%=0.71%。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,14 g N2含有分子数为NA
B.过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.2NA
C.物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl-数目为1NA
D.一定条件下,0.01 mol FeCl3与水完全反应制成胶体,其含有的Fe(OH)3胶粒数为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫及其化合物对生产、生活有重要的意义。
(1)以![]() 与
与![]() 为原料可合成尿素。已知:
为原料可合成尿素。已知:
①![]()
![]()
②![]()
![]()
③![]()
![]()
写出NH3和CO2合成尿素和液态水的热化学方程式________。
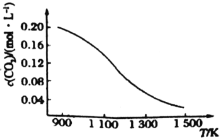
(2)高温下,CO2与足量的碳在密闭容器中实现反应:![]() 。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
(3)一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:
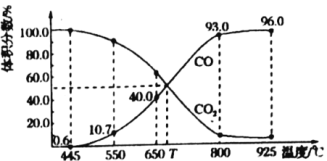
①650℃时,反应达平衡后![]() 的转化率为________。
的转化率为________。
②![]() ℃时,平衡常数
℃时,平衡常数![]() ________
________![]() (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 体积分数)。
体积分数)。
(4)![]() 与
与![]() 能发生反应:
能发生反应:![]()
![]() 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定![]() 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
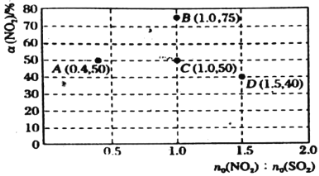
①当容器内________(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D.![]() 的体积分数
的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
③若A点对应实验中,![]() 的起始浓度为
的起始浓度为![]() ,经过
,经过![]() 达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率![]() ________
________![]() 。
。
④图中C、D两点对应的温度分别为![]() ℃和
℃和![]() ℃,通过计算判断
℃,通过计算判断![]() ________
________![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们中的两种或三种元素间形成的化合物,Y元素的焰色反应呈黄色,Y、Z、Q的最高价氧化物对应水化物相互之间可反应。B是两性氢氧化物;D是由W与Q形成的化合物,常温下,![]() 溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
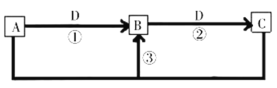
A.可通过电解熔融的C得到Z单质
B.X元素的氢化物沸点比同主族元素的氢化物高
C.W、X、Y、Z元素的原子半径大小为![]()
D.A的水溶液呈弱碱性,是因为含有元素Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.800℃下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时CO物质的量分数为33.3%
D.800℃下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时CO转化率为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量稀硫酸及足量的氧化铜制单质铜,设计了以下两种方案:
先用铁与稀硫酸反应产生氢气,再用氢气还原氧化铜得到单质铜;
先用稀硫酸溶解氧化铜得到硫酸铜溶液,再与铁发生置换反应得到单质铜。
若按实验原则进行操作,则两者制得单质铜的质量( )
A.一样多
B.①多
C.②多
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是


A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
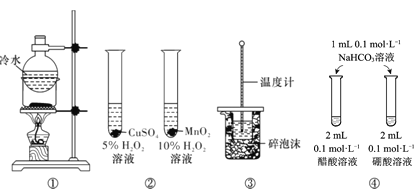
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com