
【题目】海水中Mg元素只要以MgCl2的形式存在,海水提镁的主要流程如下:

(1)下列说法不正确的是___________。
A.试剂M是盐酸 B.生石灰在食品工业中常用于防潮剂
C.操作b只是过滤 D.MgCl2电解为Mg时,Mg2+得到的电子数为2NA
(2)沉淀池中的主要反应化学方程式为________________________________。
(3)为了得到纯净的Mg(OH)2,操作a是_________,实验室洗涤沉淀的具体操作是___________________。
(4)已知常温下Ca(OH)2溶解度为m 克,则饱和石灰水的质量分数为_____________(列出计算的表达式即可,下同),若饱和石灰水密度为1g/mL,则饱和石灰水溶液的物质的量浓度为___________________。
【答案】 CD MgCl2+Ca(OH)2=Mg(OH)2+CaCl2 过滤 向漏斗中加入蒸馏水,浸没固体,低于滤纸边缘,静置流下,重复2~3次 ![]()
![]()
【解析】(1)A.由氢氧化镁生成氯化镁应加入稀盐酸,试剂M是盐酸,A正确;B.生石灰能与水反应具有很好的吸水性,可作食品工业中的防潮剂,B正确;C.氯化镁溶液需要蒸发浓缩结晶过滤等一系列操作才能得到氯化镁晶体,C错误;D.MgCl2电解为Mg时,每摩尔Mg2+得到的电子数为2NA,D错误,答案CD;(2)沉淀池中得到氢氧化镁,发生反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2+CaCl2;(3)为了得到纯净的Mg(OH)2,要对沉淀过滤与多次洗涤,实验室洗涤沉淀的正确操作是向漏斗中加入蒸馏水,浸没固体,低于滤纸边缘,静置流下,重复2~3次;(4)设溶剂为100g,则此时溶解的Ca(OH)2的质量mg,因此饱和石灰水的质量分数为![]() ;饱和石灰水密度约为1g/mL,则根据
;饱和石灰水密度约为1g/mL,则根据![]() 可知物质的量浓度为
可知物质的量浓度为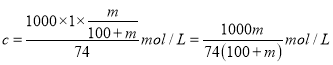 。
。


科目:高中化学 来源: 题型:
【题目】工业合成氨的反应是在500 ℃左右进行,主要原因是( )
A.500 ℃时反应速率最快
B.500 ℃时的平衡浓度最大
C.500 ℃时的转化率最高
D.500 ℃催化剂能发挥最大效力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2×10-3mol的XO42-还原时,恰好用去0.1mol/L的Na2SO3溶液30mL(Na2SO3反应后生成了Na2SO4),则元素X在还原产物中的化合价是
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是 ( )
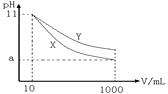
A. X、Y两种碱溶液的物质的量浓度一定相等
B. 稀释后,X溶液的碱性比Y溶液的碱性强
C. 完全中和X、Y两种溶液时,消耗同浓度盐酸的体积 关系为VX>VY
D. 若9<a<11,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示:

(1)在25℃时,有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。如果加入蒸馏水,就加入_______ mL;如果加入pH = 10的NaOH溶液,应加入_______mL(忽略溶液混合后体积的微小变化);
(2)当温度升高到B点时,水的离子积为________;加酸_______(填能或不能)使水的离子积由E点变到B点;
(3)在100℃下,将pH=8的氢氧化钠溶液与pH=5的盐酸溶液混合并保持100℃,欲使溶液的pH=7,则氢氧化钠溶液与盐酸的体积比为_________(忽略溶液混合后体积的微小变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
①某烷烃B的结构简式为CH3CH(CH3)CH(C2H5),有一种烷烃C 与烷烃B 是同分异构体,它却不能由任何烯烃催化加氢得到,则C 的结构简式为______。
②烃![]() 与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
与Br2加成时(物质的量之比为1: 1),所得产物可能有____种。
③乙醛和足量银氨溶液反应的化学方程式__________。
④足量浓溴水与苯酚反应的化学方程式__________。
⑤1mol  与足量NaOH溶液反应,最多可消耗NaOH_______mol。
与足量NaOH溶液反应,最多可消耗NaOH_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B. pH在5.6~7之间的降水通常称为酸雨
C. 合金的熔点一般比成分金属的低
D. 硫粉在过量的纯氧中燃烧可生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量与消耗Ba(OH)2的物质的量的关系如下图所示,下列说法正确的是

A. O~b点间的任意一点a的溶液均显酸性
B. b、c两点溶液均呈中性
C. b、c两点沉淀的物质的量之比为4:3
D. c点溶液呈碱性,原因是A1O2-+H++H2O===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钡(BaSO4)在医疗上用作胃肠道造影剂,也可以用做白色颜料,用于制造钡盐等。工业上利用重晶石矿石(主要含有BaSO4,还含有少量的SiO2、Al2O3、Fe2O3、FeS2、Na2O、K2O等杂质)制备硫酸钡以及分离某些金属的流程图如下。

(1)煅烧过程中产生的污染性气体主要是___________________________ 。
(2)检验第一次水洗液中有K+存在的实验现象是_____________________________。
(3)①反应生成沉淀的化学式____________,②反应的离子方程式为___________。
(4)该流程制得的Al可用于生产铝合金。某镁铝合金10.2g溶于500mL 4 mol·L-1的盐酸中,若加入2 mol·L-1氢氧化钠溶液,要使沉淀得到最大量,则需加入此NaOH溶液的体积为_____________________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com