
 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.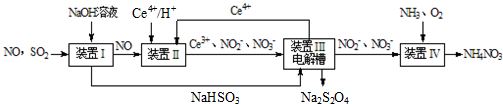
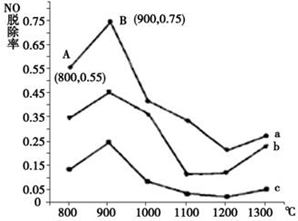
分析 Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率=$\frac{一氧化氮脱硫的变化}{变化时间}$×100%;
②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1;
(2)NH3脱除NO的化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(l),可结合盖斯定律计算;
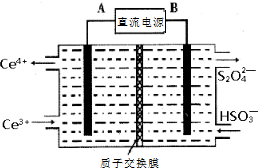
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,以此解答.
解答 解:Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率=$\frac{(75%-55%)×6×1{0}^{-4}}{0.8s}$=1.5×10-4mg/(m3•s),
故答案为:1.5×10-4;
②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,
故答案为:3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;
(2)已知在25℃,101kPa时:
①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
③N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
利用盖斯定律,将②×3-①×2-③×3可得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=-2070 kJ/mol,
故答案为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=-2070 kJ/mol;
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3-+4H+,故答案为:3Ce4++NO+2H2O═3Ce3++NO3-+4H+;
(4)阴极发生还原反应,电极方程式为2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(5)amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3,S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,由化合价升降总数相等可知4x+a=3b,x=$\frac{3b-a}{4}$,则氧气的体积为$\frac{3b-a}{4}$mol×22.4L/mol=5.6(3b-a)L,
故答案为:5.6(3b-a).
点评 本题考查了无机化工生产流程图,为高频考点,涉及氧化还原反应、计算、电化学等知识,综合性强,侧重分析、计算能力的考查,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: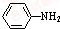 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是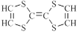 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为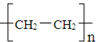 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | “地沟油”可以制成肥皂,从而提高资源的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
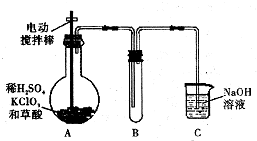 ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com