
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为 __________;基态 Mn原子核外有____种运动状态不同的电子,M层的电子云有_______种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是 ____________________________________
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验 K+的存在。与NO2-互为等电子体的微粒__________(写出一种),K3[Co(NO2)6]中存在的作用力有___________a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH4-的空间构型为____________
(5)FeO 是离子晶体,其晶格能可通过下图中的 Born—Haber 循环计算得到。
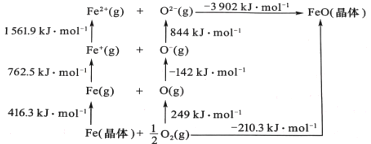
可知,O原子的第一电子亲和能为 ________kJmol-1,FeO晶格能为________kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中 Cu 均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为_______________,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为_________pm
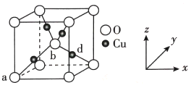
(列出计算式即可)
【答案】3d34s2 25 9 Ga:[Ar]3d104s24p1、Zn:[Ar]3d104s2,Zn:3d104s2,3d全满,能量低,稳定,难失电子,因此Ga的第一电离能明显低于Zn O3 a b c d 正四面体形 142 3902 ![]()
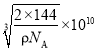
【解析】
⑴钒是23号元素,基态钒原子排布式为1s22s22p63s23p63d34s2;一个电子就是一种运动状态的电子;M层上能级有3s、3p、3d;
⑵从原子结构和3d能级全满角度分析;
⑶根据价电子N-=O,书写等电子体,NO2-含有σ键和π键,配离子[Co(NO2)6]3存在配位键,配离子[Co(NO2)6]3与K+形成离子键;
⑷计算BH4-的价层电子对数,根据价层电子互斥理论模型来写空间构型;
⑸第一电子亲和能为气态基态电中性基态原子获得一个电子变为气态一价负离子放出的能量;晶格能是指气态离子形成1mol离子晶体所释放的能量;
⑹d点在体对角线的四分之一处,与a点相对的位置,因此得d的坐标参数,根据晶体结构得到Cu、O个数和化学式,根据体积公式计算体积,再得晶胞参数。
⑴钒是23号元素,基态钒原子排布式为1s22s22p63s23p63d34s2,其价层电子的排布式为 3d34s2;一个电子就是一种运动状态的电子,因此基态Mn原子核外有25种运动状态不同的电子,M层上能级有3s、3p、3d,因此M层的电子云有9种不同的伸展方向,故答案为:3d34s2;25;9;
⑵第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,从原子结构角度分析,其原因是Ga:[Ar]3d104s24p1、Zn:[Ar]3d104s2,Zn:3d104s2,3d全满,能量低,稳定,难失电子,因此Ga的第一电离能明显低于Zn,故答案为:Ga:[Ar]3d104s24p1、Zn:[Ar]3d104s2,Zn:3d104s2,3d全满,能量低,稳定,难失电子,因此Ga的第一电离能明显低于Zn;
⑶NO2-与钴盐形成的配离子[Co(NO2)6]3可用于检验 K+的存在。根据价电子N-=O,因此与NO2-互为等电子体的微粒O3,K3[Co(NO2)6]中NO2-含有σ键和π键,配离子[Co(NO2)6]3存在配位键,配离子[Co(NO2)6]3与K+形成离子键,因此K3[Co(NO2)6]中的作用力有a b c d,故答案为:O3;a b c d;
⑷BH4-的价层电子对数为![]() ,价层电子互斥理论模型为四面体形,空间构型为正四面体形,故答案为:正四面体形;
,价层电子互斥理论模型为四面体形,空间构型为正四面体形,故答案为:正四面体形;
⑸第一电子亲和能为气态基态电中性基态原子获得一个电子变为气态一价负离子放出的能量,因此O原子的第一电子亲和能为142 kJ·mol1,晶格能是指气态离子形成1mol离子晶体所释放的能量,因此FeO晶格能为3902 kJ·mol1,故答案为:142;3902;
⑹d点在体对角线的四分之一处,与a点相对的位置,因此d的坐标参数为![]() ,根据晶体结构得到Cu有4个,O有
,根据晶体结构得到Cu有4个,O有![]() ,因此化学式为Cu2O,根据体积公式得到
,因此化学式为Cu2O,根据体积公式得到 ,则晶胞参数为
,则晶胞参数为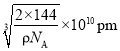 ,故答案为:
,故答案为:![]() ;
;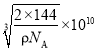 。
。


科目:高中化学 来源: 题型:
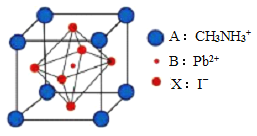
【题目】新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。 一种钙钛矿太阳能电池材料的晶胞如图所示。
请按要求回答下列有关问题:
(1)构成 CH3NH3 的三种元素中电负性最小的是_____________; 写出碳原子的电子排布式为__________。
(2)Pb 与 C 同主族,比 C 的周期序数大 4,写出 Pb 原子最外层电子的轨道表示式(即电子排布图)__________________。
(3)有关 NH3 的结构与性质探究
① NH3 分子中所含化学键是____________(从“极性键”、“非极性键”、“配位键”、 “离子键”、“σ键”或“ π键”中选填符合的名称);N 原子的杂化形式为__________。
② NH3 分子的 VSEPR 模型名称为_________,分子的空间结构(即立体构型) 为______。
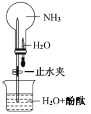
③如图所示,探究 NH3 的性质时,打开止水夹,挤压胶头滴管,可以观察到烧瓶中迅速产生红色喷泉。请用必要的分子结构 与性质的知识和化学用语解释产生该现象的原因:_________、________。
(4)该钙钛矿太阳能电池材料的化学式为________________;该晶胞中,与 I- 紧邻的 I- 个数为_____________; 测定其晶体结构特征最可靠的方法是____________实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s、灰)![]() Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
Sn(s、白) ΔH3=+2.1kJ/mol,下列说法不正确的是( )
A.灰锡与白锡互为同素异形体
B.锡在常温下以白锡状态存在
C.白锡转化为灰锡的反应是放热反应
D.ΔH1﹥ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂,且A只有一种一氯取代物B,在一定条件下A可以发生如下变化:
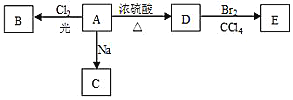
(1)A分子中的官能团名称是___,A的结构简式是___;
(2)写出下列化学方程式:
A→B:___;A→D:___;
(3)A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2 微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
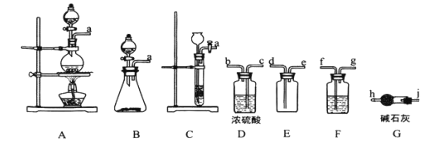
(1)制备 Cl2 的发生装置可以选用 _________ (填字母代号)装置,发生反应的离子方程式为________________________________________ 。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______→______→ _____→________→_______→______→______→______。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO
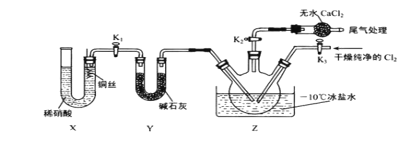
①实验室也可用 B 装置制备 NO , X 装置的优点为___________________ 。
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是 ___________________,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
(4)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。
①设计实验证明 HNO2 是弱酸:_________________________________________。(仅提供的试剂:1 molL-1 盐酸、 1 molL-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____亚硝酰氯(ClNO)的质量分数为 _________。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
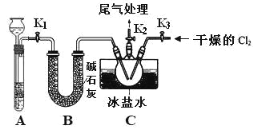
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
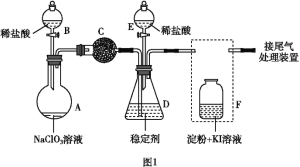
(1)仪器A的名称是_______________________。
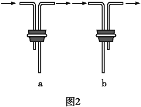
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com