
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:不详 题型:填空题
| | X | Y | Z | M | R | Q |
| 原子半径/nm | | | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 | | -4,+4 | | -2 | -1,+7 | +3 |
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
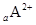 、
、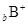 、
、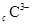 、
、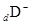 都具有相同的电子层结构,则下列叙述正的是
都具有相同的电子层结构,则下列叙述正的是 | A.原子半径A>B>D>C | B.原子序数d>c>b>a |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原性:HF>HCI>HBr>HI | B.稳定性:HF<HCl<HBr<HI |
| C.与水反应由易到难:Cl2>Br2>I2>F2 | D.密度:F2<Cl2<Br2<I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有② | B.只有②④ | C.只有②⑤⑥ | D.只有①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
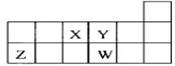
| A.元素Z位于元素周期表中第3周期第ⅠA族 |
| B.原子半径的大小顺序为:rW> rZ >rY> rX |
| C.Y、W元素的氢化物,其化学式都为H2R |
| D.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第3周期ⅤB族 | B.第4周期ⅡB族 |
| C.第4周期Ⅷ族 | D.第4周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com