
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D.相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下测得某无色溶液中由水电离出的H+浓度为1×2013—13mol/L,又知该溶液中还有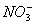 、Na+、
、Na+、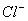 ,那么该溶液中还一定存在的离子是 ( )
,那么该溶液中还一定存在的离子是 ( )
A.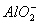 、
、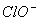 B.Mg2+、、
B.Mg2+、、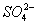 C.Fe2+ 、Cu2+ D.Ba2+、K+
C.Fe2+ 、Cu2+ D.Ba2+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A.C(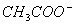 )>C(Na+)
)>C(Na+)
B.C(CH3COOH)>C(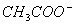 )
)
C.2C(H+)=C(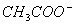 )-C(CH3COOH)
)-C(CH3COOH)
D.C(CH3COOH)+ C(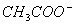 )=0.01mol/L
)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,水的离子积为1.0×12-12,由此可知在该温度时纯水电离的c(H+)为
A. 1.0×12-7 B. 1.0×12-2 C. 1.0×12-6 D. 1.0×12-14
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将衡氨水与稀盐酸混合时,不可能出现的结果是 ( )
A.pH>7,c(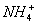 )+c(H+)=c(
)+c(H+)=c(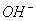 )+c(
)+c( )
)
B.pH<7,c(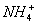 )+c(H+)=c(
)+c(H+)=c(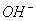 )+c(
)+c( )
)
C.pH=7,c(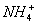 )> c(
)> c( )>c(H+)=c(
)>c(H+)=c(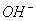 )
)
D.pH<7, c( )>c(
)>c(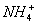 )> c(H+)>c(
)> c(H+)>c(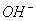 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定的温度下,可逆反应A(g)+3B(g)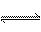 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C分解速率与B生成速率相等 B.A、B、C的浓度不再变化
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为132
查看答案和解析>>
科目:高中化学 来源: 题型:
生产自来水的流程如图所示:回答下列问题。
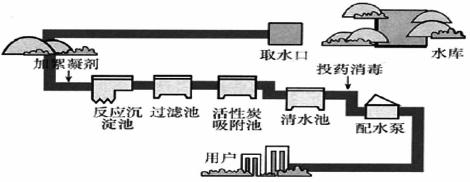
(1)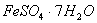 是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
(2)天然水中含有较多的钙、镁离子,称为硬水。生活中常用__________方法来降低水的硬度。
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是__________。
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式__________。
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
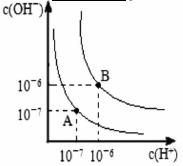
①100℃时1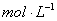 的NaOH溶液中,由水电离出的c(H+)=________
的NaOH溶液中,由水电离出的c(H+)=________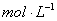 ,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有__________(填字母)。
A. 溶液中一直存在: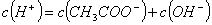
B. 加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C. 加入过程中,溶液中所有离子浓度逐渐增大
D. 加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E. 用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com