
| 57 |
| 12 |
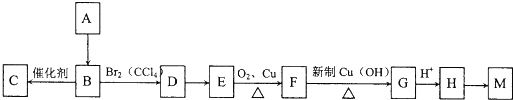
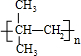 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化为E,E可以连续氧化生成G,故D水解生成E,E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化为E,E可以连续氧化生成G,故D水解生成E,E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为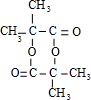 ,据此解答.
,据此解答.| 57 |
| 12 |
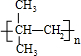 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化为E,E可以连续氧化生成G,故D水解生成E,E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化为E,E可以连续氧化生成G,故D水解生成E,E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为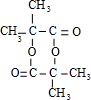 ,
,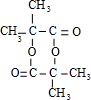 ,故答案为:2-甲基-1,2-丙二醇;
,故答案为:2-甲基-1,2-丙二醇;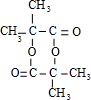 ;
;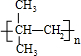 ,反应方程式为:n(CH3)2C=CH2
,反应方程式为:n(CH3)2C=CH2| 催化剂 |
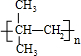 ,
,| Cu |
| △ |
| 催化剂 |
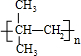 ;
;| Cu |
| △ |


科目:高中化学 来源: 题型:
| A、向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、向Fe2O3溶液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| D、MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
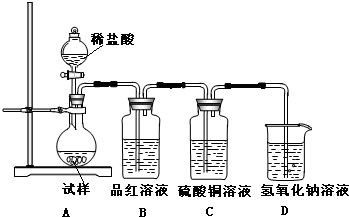 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液 体积* | 溶液温度 | 中和热(△H) | ||
| t1 | t2 | ||||
| a | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.3℃ | |
| 0.5 mol?L-1 HCl溶液 | 50 mL | ||||
| b | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.5℃ | |
| 0.5 mol?L-1 HCl 溶液 | 50 mL | ||||
. |
| △t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列说法正确的是( )
,下列说法正确的是( )| A、该有机物分子式为:C10H8O6 |
| B、分子中最多有9个碳原子共平面 |
| C、该有机物可发生取代反应、还原反应,不能发生银镜反应 |
| D、1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com