
【题目】氧化还原反应原理在化学中有广泛的运用,比如可以用酸性高锰酸钾溶液来测定双氧水的浓度。已知该反应中MnO4-只发生如下过程:MnO4-→Mn2+
(1)该反应中还原剂是_________________;
(2)写出该反应的离子方程式________________________________;
(3)如果反应中转移了0.5mol电子,则产生的气体在标准状况下的体积为____________L。
【答案】 H2O2 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O 5.6
【解析】试题分析:本题考查氧化还原反应的基本概念和计算,离子方程式的书写。
(1)Mn元素的化合价由MnO4-中的+7价降至Mn2+中的+2价,Mn元素的化合价降低5价,MnO4-作氧化剂,被还原,则H2O2在反应中作还原剂,被氧化。
(2)H2O2作还原剂,被氧化成O2,O元素的化合价由-1价升至0价,可写出反应MnO4-+H2O2→Mn2++O2↑,根据得失电子守恒配平为2MnO4-+5H2O2→2Mn2++5O2↑,结合溶液呈酸性、原子守恒和电荷守恒可写出离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。
(3)1molH2O2被氧化失去2mol电子生成1molO2,若反应中转移0.5mol电子,则生成O2物质的量为0.25mol,在标准状况下O2的体积为0.25mol![]() 22.4L/mol=5.6L。
22.4L/mol=5.6L。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.某元素从化合态变为游离态时,该元素一定被还原
D.还原剂在反应中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
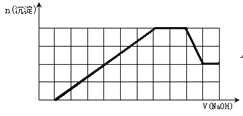
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C. 原溶液中一定含有SO42-和Na+
D. 反应最后形成的溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是( )
A.用NaHCO3溶液鉴别乙醇、乙酸和苯
B.苯和浓溴水混合,加入铁作催化剂制溴苯
C.裂化汽油可用作萃取剂来萃取溴水中的溴
D.除去乙烷中的乙烯,将混合气体通过盛有酸性KMnO4溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是( )
A.由于铝的活泼性强,故工业上采用电解熔融A1C13的方法生产单质铝
B.将钠投入氯化镁饱和溶液中,可置换出镁单质
C.冶炼金属的方法,本质上是由金属的活泼性决定的
D.铝热反应需要在高温下进行,是一个典型的吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
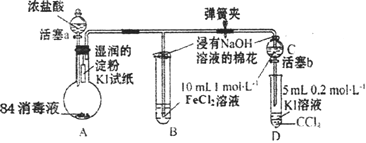
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式________。
(2)验证氯气的氧化性强于碘单质的实验现象是________。
(3)B中溶液发生反应的离子方程式是________。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是________,对应反应的离子方程式是________。
(5)浸有氢氧化钠溶液的棉花作用是________。
(6)过程Ⅲ实验的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴化钾、碘化钾的混合溶液中通入足量的氯气,再加热将溶液蒸干并灼烧,最后残留的物质是( )
A.KClB.KCl、I2C.KCl、KBrD.KCl、Br2、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
滴定次数 | 用去NaOH溶液的体积 | ||
滴定前刻度 | 滴定后刻度 | 体积(mL) | |
1 | 3.20 | 22.48 | |
2 | 1.23 | 20.55 | |
3 | — | — | |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是()
A.酸式滴定管
B.烧杯
C.100 mL容量瓶
D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用。
(4)滴定操作时,左手应 , 观察滴定管里液面的高度时应注意。
(5)选用的合适指示剂是 , 变色情况是。
(6)计算稀释后容量瓶中醋酸的物质的量浓度。
(7)计算“老谢琼醋”中醋酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO ![]() ?+6H++5H2O2═2Mn2++5O2↑+8H2O
?+6H++5H2O2═2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com