
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
分析 A.1mol C3H8所含有的共价键数目为10NA;
B.苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键;
C.甲基中含有9个电子,1mol甲基中含有9mol电子;
D.乙烯、丙烯的最简式为CH2,根据最简式计算出混合物中含有的原子数目.
解答 解:A.1mol C3H8所含有的共价键数目为10NA,故0.1mol C3H8所含有的共价键数目为NA,故A错误;
B.苯分子中碳碳键为一种独特键,不存在碳碳双键,故B错误;
C.15g甲基的物质的量为1mol,1mol甲基中含有9mol电子,含有电子数为9NA,故C错误;
D.14g乙烯、丙烯的混合气体中含有1mol最简式CH2,含有1molC、2molH,总共含有3mol原子,含有的原子数为3NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确苯分子中不存在碳碳双键、甲基中含有9个电子.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
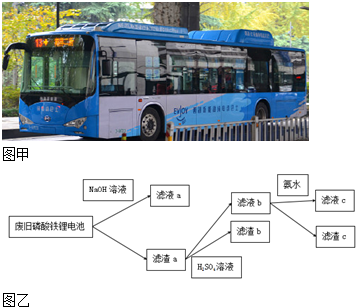
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60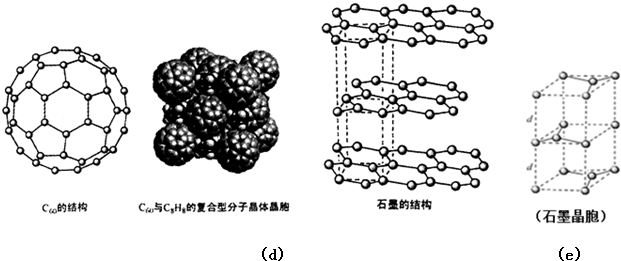
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
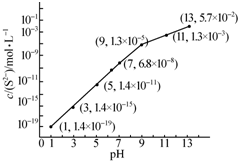 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com