
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量,再根据N=nNA计算氨气分子数目,氢原子为氨气分子的3倍,根据V=nVm计算氨气体积,含有电子物质的量为氨气的10倍,根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(2)计算二者物质的量,再根据总质量、总物质的量列方程计算CO和CO2的物质的量,根据V=nVm计算CO体积,根据m=nM计算CO质量;
(3)根据n=$\frac{m}{M}$计算Na2CO3•10H2O物质的量,碳酸钠物质的量等于Na2CO3•10H2O的物质的量,根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(4)体积之比等于物质的量之比,结合总质量计算各物质相应物质的量,再根据V=nVm计算气体体积;
(5)根据n=$\frac{N}{{N}_{A}}$计算气体物质的量,再根据M=$\frac{m}{n}$计算该气体的摩尔质量;
(6)根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,根据m=nM计算HCl质量,溶液质量=水的质量+HCl质量,再根据V=$\frac{m}{ρ}$计算溶液体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:(1)氨气物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,氨气分子数目为0.2mol×6.02×1023mol-1=1.204×1023,氢原子数目为3×1.204×1023=3.612×1023,标况下氨气体积为0.2mol×22.4L/mol=4.48L,含有电子物质的量为0.2mol×10=2mol,溶液物质的量浓度为$\frac{0.2mol}{0.2L}$=1mol/L;
故答案为:1.204×1023;3.612×1023;4.48;2;1;
(2)CO和CO2混合气体总物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,设二者物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=1}\\{28x+44y=36}\end{array}\right.$,解得x=y=0.5,故标况下CO体积为0.5mol×22.4L/mol=11.2L,CO质量为0.5mol×28gmol=14g,
故答案为:11.2;14;
(3)Na2CO3•10H2O物质的量=$\frac{1.43g}{286g/mol}$=0.005mol,碳酸钠物质的量等于Na2CO3•10H2O的物质的量,溶液物质的量浓度为$\frac{0.005mol}{0.1L}$=0.05mol/L,
故答案为:0.05;
(4)同温同压下,体积比为1:2:3所组成的N2、O2和CO2的物质的量之比为1:2:3,设氮气物质的量为n mol,则28n+2n×32+3n×44=33.6,解得n=0.15,故标况下混合气体总体积为0.15mol×6×22.4L/mol=20.16L,
故答案为:20.16;
(5)该气体物质的量为$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,该气体的摩尔质量为$\frac{32g}{1mol}$=32g/mol,
故答案为:32g/mol;
(6)HCl物质的量为$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,HCl质量为$\frac{36.5a}{22.4}$g,溶液质量=(1000+$\frac{36.5a}{22.4}$)g,溶液体积=$\frac{(1000+\frac{36.5a}{22.4})g}{1000bg/L}$=$\frac{22400+36.5a}{22400b}$L,溶液物质的量浓度为$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22400b}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,
故答案为:$\frac{1000ab}{22400+36.5a}$mol/L.
点评 本题考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的计算.


科目:高中化学 来源: 题型:解答题
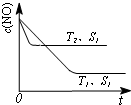 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: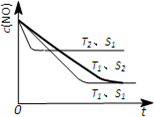 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
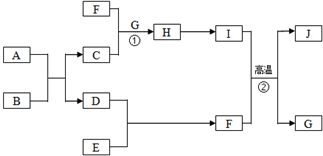 有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题:
有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题: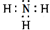 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2被还原 | |
| B. | 该反应是置换反应 | |
| C. | NH3是氧化剂 | |
| D. | 若有17gNH3参加反应,则反应中转移的电子数为10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2NA | |
| B. | 每生成0.15 molH2,被还原的水分子数目为0.3NA | |
| C. | 当加入2.7gAl时,转移的电子数目为0.3NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
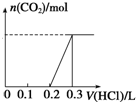 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2 | B. | HCl和NH3 | C. | H2和Cl2 | D. | CO和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com