

分析 (1)常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水;
(3)根据mg铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数,能用该方法测定的实验现象是C中高锰酸钾溶液紫色未褪去证明被完全吸收;
(4)因为铁碳合金中的铁可以与稀硫酸反应生成氢气,瓶总质量的减少量即为氢气的生成量.
解答 解:(1)常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,没有二氧化硫生成,故A、B均无明显现象,
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为$\frac{bg}{44g/mol}$×12g/mol=$\frac{3b}{11}$g,则含铁的质量为ag-$\frac{3b}{11}$g,铁的质量分数为$\frac{ag-\frac{3b}{11}g}{ag}$×100%=(1-$\frac{3b}{11a}$)×100%=$\frac{11a-3b}{11a}$×100%,能用该方法测定的前提是二氧化硫完全被BC吸收,所以实验现象是C中紫色未褪尽,即说明二氧化硫已完全被吸收,
故答案为:$\frac{11a-3b}{11a}$×100%;C中紫色未褪尽;
(4)因为铁碳合金中的铁可以与稀硫酸反应生成氢气,瓶总质量的减少量即为氢气的生成量,而铁的质量可以通过释放氢气的质量求出,进而计算铁的质量分数;测定反应前后装置和药品的总质量是最简便的实验操作;用排水法测定H2的体积增加实验操作收集时易损耗气体造成误差;反应结束后,过滤、洗涤、称量残渣的质量,需要过滤装置、天平称量等多部实验操作,增加操作仪器和步骤会对实验结果产生较多的误差,所以只有C是最简单的操作,
故答案为:C.
点评 本题考查浓硫酸的性质及实验,熟悉装置及装置中每部分的作用是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题

| A. | 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
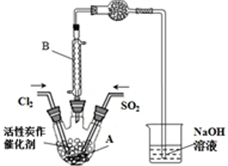 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的比例模型 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | H2与H+互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入明矾可以使海水淡化,用于解决淡水供应危机 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 将地沟油回收再加工为食用油,以减缓水体富营养化 | |
| D. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
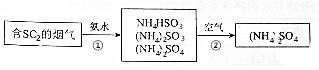 燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.
燃煤产生的烟气中含有较多的SO2,直接排放会严重污染空气.氨法脱硫是一种操作简单、效率高的脱硫方法,其反应原理可用如图表示.| 离子 | NH4+ | SO32- | HSO3- | SO42- |
| 浓度(mol/L) | 1.22 | 0.55 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl; ,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.
,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁溶于盐酸:OH-+H+═H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Ag++Cu2+ | |
| C. | 将稀硫酸加入氢氧化钡溶液:H++OH-═H2O | |
| D. | 碳酸钠溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com