
| A. | 摩尔质量为17 g•mol-1 | |
| B. | 所含的分子数目约为9.03×1023 | |
| C. | 在标准状况下体积约为33.6L | |
| D. | 溶于水制成0.5L溶液时物质的量浓度为1.5mol•L-1 |
分析 A.氨气的相对分子质量为17,其摩尔质量为17g/mol;
B.根据N=nNA计算出含有的分子数;
C.根据V=nVm计算出氨气在标准状况下的体积;
D.根据c=$\frac{n}{V}$计算出所得溶液的浓度.
解答 解:A.NH3的摩尔质量与物质的量大小无关,其摩尔质量为17 g•mol-1,故A正确;
B.1.5mol NH3所含的分子数目约为:6.02×1023mol-1×1.5mol=9.03×1023,故B正确;
C.在标准状况下体积约为:22.4L/mol×1.5mol=33.6L,故C正确;
D.溶于水制成0.5L溶液时物质的量浓度为:$\frac{1.5mol}{0.5L}$=3mol•L-1,故D错误;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量、物质的量浓度等物理量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,可加快反应速率,目的是提高生产效率 | |
| B. | 使用冰箱保存食物,是利用了化学反应速率理论 | |
| C. | 化学反应速率理论是研究怎样提高原料转化率 | |
| D. | 化学平衡理论是研究怎样使用有限原料多出产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
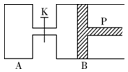 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com