
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL 7.0 mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00 mL,用2.00 mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50 mL。

步骤二,氯的测定:准确称取橙黄色晶体w g,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是_________________________;
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在______(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为__________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”“偏低”或“无影响”);
(5)测定氯的过程中,出现浅红色沉淀时,若溶液中c(![]() )=0.002 5 mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因____________(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×1012,Ksp (AgCl)= 1.8×1010
)=0.002 5 mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因____________(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×1012,Ksp (AgCl)= 1.8×1010
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________________________,制备M的过程中温度不能过高的原因是______________________。
【答案】 平衡气压(当 A 中压力过大时,安全管中液面上升,使 A 瓶中压力稳定) A 42.00 偏高 当溶液中出现 Ag2CrO4 沉淀时,c2(Ag+)×c( CrO24 )=1.0×1012,代入求得:c(Ag+)=2.0×105mol/L。此时 c(Ag+)×c(Cl)=1.8×1010,代入求得 c(Cl)=9.0×106mol/L<1.0×105mol/L,所以当出现浅红色沉淀时 Cl已完全沉淀 ![]()
![]()
![]() 温度过高过氧化氢分解、氨气逸出
温度过高过氧化氢分解、氨气逸出
【解析】(1). 当 A 中压力过大时,安全管中液面上升,使 A 瓶中压力稳定,起到平衡气压的作用;
(2).三颈瓶中需要通入水蒸气,所以A出应放置酒精灯加热;
(3).m(N)=14*n(NH4+)=14*[n(HCl)- n(NaOH)]=14*[(0.5*7*25/500-2*0.0125)*20]=14*0.15*20=42g
(4).将挥发的盐酸计入消耗量,将大于实际使用的量,即计算的n(NH4+)大于实际n(NH4+),所以将造成N含量偏高;
(5).若采用Ag2CrO4作为指示剂,溶液中出现淡红色沉淀不再消失时,Cl必须完全沉淀。根据沉淀的溶度积计算,当溶液中出现 Ag2CrO4 沉淀时,c2(Ag+)×c( CrO24 )=1.0×1012,代入求得:c(Ag+)=2.0×105mol/L。此时 c(Ag+)×c(Cl)=1.8×1010,代入求得 c(Cl)=9.0×106mol/L<1.0×105mol/L,所以当出现浅红色沉淀时 Cl已完全沉淀;
(6).Co:NH3:Cl=1:6:3,NH3以配位键的形式结合,所以M的化学式为:CoCl3·6 NH3,由题得![]() ;温度过高过氧化氢分解、氨气逸出。
;温度过高过氧化氢分解、氨气逸出。


科目:高中化学 来源: 题型:
【题目】同温同压下,向两个体积可变的密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是
A. 两种气体的密度之比是3∶2 B. 两个容器的体积之比为2∶3
C. 两种气体的分子数目相等 D. 两气体的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶,是一种重要的有机高分子材料。其结构为 。其合成路线如下图:
。其合成路线如下图:

已知:![]()
回答下列问题:
(1)B的名称是_________________,C中官能团的名称是________________________。
(2)A→D的反应类型为________________________________。
(3)E的结构简式为____________________。
(4)写出C+F→PET的化学反应方程式______________________________。
(5)G是F的同系物,其相对分子质量比F多14,则符合该条件的G的结构共有_________种,写出其中苯环上只有一个取代基的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
(1)乙醇、乙酸和浓硫酸的加入顺序是___________。制取乙酸乙酯的反应原理为:__________________________________。
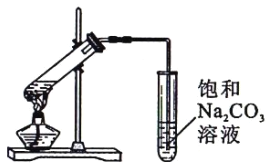
(2)为证明浓硫酸在该反应中起到了______和________的作用, 为证明其作用,某同学利用上图所示装置进行了以下四个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
实验编 号 | 试管I中的试剂 | 试管II中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL18mo/L浓硫酸 | 5.0 | |
B | 3mL乙醇、2mL乙酸 | 饱和碳酸钠溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_____mL和_____mol/L。
②分析实验_______(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________。
(3)饱和碳酸钠溶液的作用是溶解没有反应的乙醇,除去没有反应的乙酸和___________,本实验装置有明显的缺陷,其可能造成的后果是__________________________。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是_______________。
(5)分离饱和碳酸钠溶液和乙酸乙酯的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)Ga的原子序数为______。
(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中每生成3molH2时,就会放出30.8kJ的热量。
①反应的热化学方程式是________。
②反应的化学平衡翻常数表决达式是_________________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____(填字母代号).

A.Ⅰ图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图象中纵坐标可以为稼的转化率
C.Ⅲ图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体的平均相对分子质量
(3)工业上多用电解精炼法提纯稼。具体原理如下图所示:
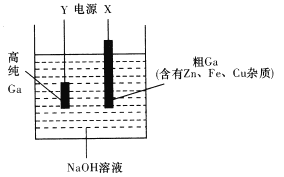
已知:金属的活动性Zn>Ga>Fe>Cu
①X为电源的_____极,电解精炼稼时阳极泥的成分是__________;
②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼, 请写出该电解过程中的电极反应方程式:阳极_________;阴极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M(NO3)2热分解化学方程式为2M(NO3)2![]() 2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
A. 74 g·mol-1 B. 148g·mol-1 C. 24 g·mol-1 D. 40 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机样品3.0 g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水中,石灰水共增重6.2 g,经过滤得到10 g 沉淀。该有机样品的组成可能是(括号内给出的是有机物的分子式)
A. 葡萄糖(C6H12O6)与蔗糖(C12H22O11) B. 醋酸与甲酸甲酯(C2H4O2)
C. 乙醇与甲醛(CH2O) D. 二甲醚(C2H6O)与乳酸(C3H6O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:

(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是________反应,③是________反应。(填反应类型)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___________________。
(4)C2的结构简式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com