
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 可以利用元素周期律预测新元素 |
分析 A.元素周期表没有填满,还可以再发现新的元素;
B.原子最外层电子数决定元素的性质;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献;
D.根据元素在周期表中的位置,结合元素周期律的相似性和递变性,可推知元素可能具有的性质.
解答 解:A.随着科学技术的发展,人们可以不断合成一些元素,元素周期表中元素的种类在不断的增加,故A错误;
B.原子最外层电子数决定元素的性质,元素周期表中元素的核外电子排布呈周期性变化,则元素性质呈周期性变化,故B正确;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献,而不是道尔顿,故C错误;
D.根据元素在周期表中的位置,结合元素周期律的相似性和递变性,可推知元素可能具有的性质,故D正确,
故选BD.
点评 本题考查元素周期表与元素周期律知识,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>②>③>① | B. | ①>②>③>④ | C. | ①>②>④>③ | D. | ①>③>②>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
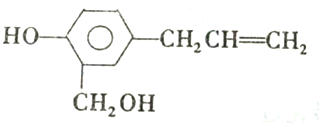 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )| A. | 等量A分别与Na和NaOH反应消耗二者的物质的量相同 | |
| B. | 1 mol A 可与2 mol Br2发生取代反应 | |
| C. | A与Na2CO3反应可放出CO2 | |
| D. | 1 mol A 可与4 mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
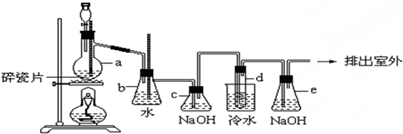
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
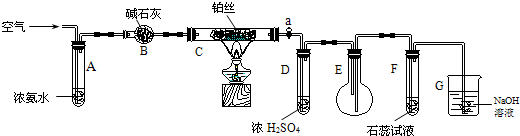
| A. | C不需要持续加热 | |
| B. | D的作用是干燥气体 | |
| C. | B是无用装置 | |
| D. | 仅用该套装置和药品无法达到检验产物的目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com