
【题目】【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。

请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
【答案】(1)加酸溶解,过滤
(2)①2Fe2++H2O2+2H+=2Fe3++2H2O ②促进Fe3+水解,沉淀完全
(3)2NiC2O4 = Ni2O3+3CO↑+CO2↑ (4)ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O 1.25a mol
(5)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
【解析】
试题分析:(1)分析工艺流程图可知,含镍废料(镍、铁、钙、镁合金为主),要使之变成离子,应该加酸溶解金属,再除去不溶物,所以操作Ⅰ为加酸溶解,过滤。
(2)①加双氧水的目的是氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入碳酸钠溶液的作用是调节pH,促进铁离子水解,沉淀完全;
(3)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应,Ni由+2价升高到+3价,则C由+3价降低到+2价,因为生成了混合气体,则另一气体为CO2,所以反应生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4 ![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
(4)ClO-具有氧化性,Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,得到的离子方程式为ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O;根据离子方程式ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O,a mol二价镍全部转化为三价镍,则参加反应的ClO-的物质的量为0.5amol,根据化学反应Cl2+2OH-═ClO-+Cl-+H2O,已知电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,参加反应的Cl2的物质的量为0.5a÷80%=0.625 a mol,进行电解时,阳极反应式为2Cl--2e-═Cl2↑,则n(e-)=0.625mol×2=1.25a mol。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,Ni的化合价由+3价降低到+2价,则正极反应为3NiO(OH)+3e-+3H2O=3Ni(OH)2+3OH-,负极是Al失电子生成NaAlO2,负极电极反应为Al-3e-+4OH-=AlO2-+2H2O,正、负极相加得电池的总反应,则该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是 ( )
A.Ba2+、OH-、NO3-、Na+ B.NH4+、OH-、SO42-、K+
C.Ca2+、H+、Cl-、CO32- D.Cu2+、SO42-、Ba2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aA(g)+bB(g) ![]() cC(g)+dD(g)
cC(g)+dD(g)![]() H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
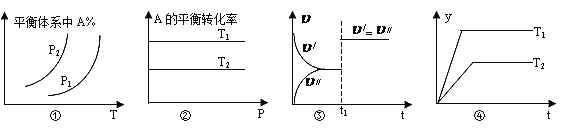
A. 图①中,若p1>p2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则![]() H<0且a+b=c+d
H<0且a+b=c+d
C. 图③中(υ/表示正反应速率,υ//表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
D. 图④中,若![]() H<0,则纵坐标不可能表示的是反应物的转化率
H<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用N2与Mg制备Mg3N2的装置如图所示(焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )

A. ①、②、③中依次盛装浓H2SO4溶液、NaOH溶液、焦性没食子酸溶液
B. 实验操作顺序为:通空气→管式电炉⑤通电加热→管式电炉④通电加热
C. ④的作用是预热经净化后的氮气
D. 当⑤的瓷舟中燃烧产生白光时,⑤可停止通电加热装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据教材中的“中和热的测定实验”,所用玻璃仪器除了烧杯、量筒、胶头滴管以外,还需要 . 已知:含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活中有着重要的作用。

请回答下列问题:
(1)图1是常温下1 mol NO2和1 mol CO反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________。
(2)如图2,在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g) ΔH。
2NO2(g) ΔH。
①在0~60 s时间段,反应速率v(N2O4)为____ mol·L-1·s-1。
②温度升高,混合气体的颜色变深,则ΔH____0(填“>”或“<”)。
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有____(填字母)。
a.向混合气体中通入N2O4 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2,发生反应的化学方程式为2NO2+2NaOH![]() NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液。
①A、B两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________________。
(HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。
②可使A、B两溶液的pH相等的方法是____(填字母)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将化学方程式表示为Cu+HNO3![]() Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。0.6 mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为____。
Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。0.6 mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com