
【题目】回答下列问题:
(1)已知下列反应:SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2 CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为 kJ;若x= 时,反应①与②放出(或吸收)的总能量为0。
(4) 一定条件,在水溶液中1 mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示
。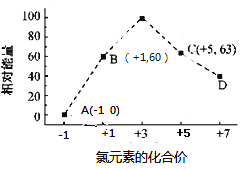
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
【答案】(1)△H1+△H2-△H3;(2)H2(g)+Cl2(g)=2HCl(g)△H=﹣183 kJ/mol;
(3)H2(g)+1/2O2(g)═H2O(g)△H=﹣252 kJ/mol;14.4;0.75.
(4)ClO4- 3ClO-(aq)= ClO3-(aq)+2Cl-(aq) △H=﹣117 kJ/mol
【解析】
试题分析:(1)已知:① SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
② ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2
③CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则根据个塑料袋可知①+②-③即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq)=CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。
(2)反应热等于反应物中键能之和与生成物中键能之和的差值,则该反应的反应热△H=436kJ/mol+243kJ/mol-2×431kJ/mol=-183 kJ/mol,因此热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=﹣183 kJ/mol;
(3)已知:①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
则根据盖斯定律可知①÷2-②即得到氢气与氧气反应生成水蒸气的热化学方程式为H2(g)+1/2O2(g)═H2O(g)△H=﹣252 kJ/mol;x=0.2时,氧气是0.2mol,因此反应①中甲烷过量,则反应①放出的能量为72kJ/mol×0.2=14.4kJ;设氧气的物质的量是xmol,水蒸气的物质的量是1-x,反应①中放出的热量是72x。反应①与②放出(或吸收)的总能量为0,则反应②吸收的热量是72x,消耗水蒸气是![]() ,解得x=0.75。
,解得x=0.75。
(4)①D点氯元素的化合价是+7价,则该处是ClO4-。
②根据化合价可知B点是次氯酸根离子,C点是氯酸根离子,A点是氯离子,反应的方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq),其中反应热△H=63 kJ/mol +0-3×60 kJ/mol=-117 kJ/mol,则B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=﹣117 kJ/mol。


科目:高中化学 来源: 题型:
【题目】【2016届北京西城一模】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】
① CuSO4与Na2SO3溶液混合可制备Cu2O。
② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 ![]()
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液
pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
![]()
【实验探究】
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_________________。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是________________。
(5)iii中砖红色沉淀消失的原因是_________________。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_________________。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图:![]() 。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
A.分子中 N、O 间形成的共价键是极性键
B.图中加“*”N原子的杂化方式为sp3
C.该物质既有氧化性又有还原性
D.15.2g 该物质含有 6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少
C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
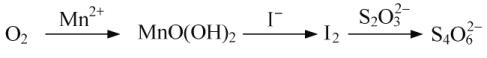
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式;_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
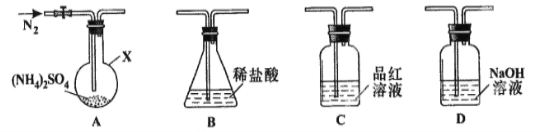
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2,品红溶液不褪色。已知中和装置B中剩余盐酸需0.2000mol/L NaOH溶液25.00 mL,且中和后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)装置B内溶液吸收气体的物质的量是__________mol;
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(3)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是 ;
(4)装置B内溶液吸收的气体是 ;
(5)(NH4)2SO4在400℃分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com