
【题目】(1)有①甲烷、②乙烷、③丙烷、④丁烷4种烷烃,试回答下列各题(填序号):
a.上述气态烃中,其一氯取代物的同分异构体只有两种的是____________。
b.等物质的量上述气态烃充分燃烧,消耗O2的量最多的是_____________。
c.等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是_________。
(2)有4种无色液态物质: a.1-己烯[CH3(CH2)3CH=CH2]、b.己烷[ CH3(CH2)4CH3]、
c.苯(![]() )、d.甲苯(
)、d.甲苯(![]() ),
),
请回答下列问题:
①能与溴水和酸性KMnO4溶液反应的是________________(写编号),
②不能与溴水反应但能与酸性KMnO4溶液反应的是________________(写编号)。
③不能与溴水和酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是________(写编号),反应的化学方程式为_____________________________________________________。
【答案】 ③ ④ ① a d c ![]() HBr
HBr
【解析】(1)a.①甲烷分子式为CH4,其一氯代物只有1种;②乙烷分子式为C2H6,其一氯代物只有1种;③丙烷分子式为C3H8,分子中有两种氢原子,其一氯代物有2种;④丁烷分子式为C4H10,正丁烷分子中有两种氢原子,其一氯代物有2种,异丁烷分子中有两种氢原子,其一氯代物有2种,所以丁烷的一氯代物有4种;故答案选③。
b.①甲烷分子式为CH4,②乙烷分子式为C2H6,③丙烷分子式为C3H8,④丁烷分子式为C4H10;它们的(x+![]() )值分别为2、3.5、5、6.5,所以丁烷的(x+
)值分别为2、3.5、5、6.5,所以丁烷的(x+![]() )值最大,故等物质的量4种气态烃充分燃烧,消耗O2的量最多的是④。
)值最大,故等物质的量4种气态烃充分燃烧,消耗O2的量最多的是④。
c.①甲烷分子式为CH4,②乙烷分子式为C2H6,③丙烷分子式为C3H8,④丁烷分子式为C4H10;甲烷的C、H原子个数比为1:4,H的质量分数最大,故等质量的4种气态烃,充分燃烧消耗O2的量最多的是①。
(2)a.1-己烯[CH3(CH2)3CH=CH2 ]分子中含有碳碳双键,能与溴水和酸性KMnO4溶液反应;b.己烷[ CH3(CH2)4CH3 ]分子中没有不饱和键,与溴水和酸性KMnO4溶液都不反应;c.苯(![]() )分子中含有特殊键,但与溴水和酸性KMnO4溶液都不反应,在铁屑作用下能与液溴反应生成溴苯;d.甲苯(
)分子中含有特殊键,但与溴水和酸性KMnO4溶液都不反应,在铁屑作用下能与液溴反应生成溴苯;d.甲苯(![]() )中的甲基能被酸性KMnO4溶液氧化成羧基。综上分析,答案为:①a;②d;③c;
)中的甲基能被酸性KMnO4溶液氧化成羧基。综上分析,答案为:①a;②d;③c;![]() HBr。
HBr。


科目:高中化学 来源: 题型:
【题目】物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 过滤 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上不能用于设计原电池反应的是( )
A. Al(OH)3(s)+NaOH(aq)=NaAlO2(aq)+2H2O(l) ΔH<0
B. CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH<0
D. H2(g)+Cl2(g)=2HCl(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏
①把饱和食盐水中的食盐提取出来
②把碘水中的碘提取出来
③用海水制取蒸馏水
④除去氧化钙中的碳酸钙
⑤分离柴油和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关获得晶体的途径,错误的是 ( )
A. 从熔融态结晶出来的硫
B. 熔融态物质急速冷却
C. 凝华得到的碘
D. 从硫酸铜饱和溶液中析出的硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
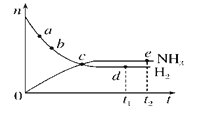
A. c点处正反应速率和逆反应速率相等
B. a点处正反应速率比b点处的大
C. d点(t1时刻)和e点(t2时刻)处n(N2)不同
D. t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基本操作正确的是( )
A.手持试管给试管里的物质加热
B.用燃着的酒精灯去点燃另一盏酒精灯
C.用天平称取药品时用手直接拿砝码
D.用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
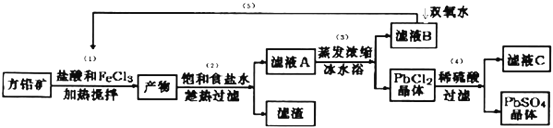
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充入一定量N2和H2,在一定条件下发生反应:N2+3H2![]() 2NH3。下列说法错误的是
2NH3。下列说法错误的是
A.使用合适催化剂可以加快反应速率
B.升高温度可以增大反应速率
C.达到化学平衡时,N2、H2和NH3物质的量浓度一定相等
D.若反应在密闭容器中进行,N2和H2不可能100%转化为NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com