
| A. | 晶体硅 | B. | 二氧化硅晶体 | C. | 干冰 | D. | 金属钾 |
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
 科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )
科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵易溶于水 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
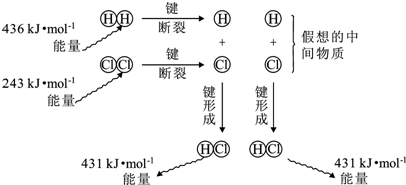
| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
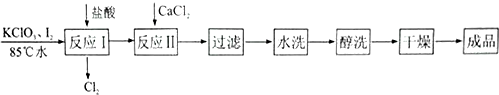
| A. | “反应I”中主要反应的离子方程式为CIO3-+5CL-+6H+=3CL2↑+3H20 | |
| B. | “反应I”适宜在水浴加热的条件下进行 | |
| C. | 进行“反应Ⅱ”之前需向溶液中滴加过量K2C03溶液除去其中的盐酸 | |
| D. | “醇洗”的目的是为了除去产品中某些不溶性杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
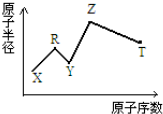 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 简单的气态氢化物的沸点和稳定性排序均为:Y>T | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、M的单质在相同条件下与相同浓度稀盐酸反应的反应速率为L>M | |
| B. | M与T形成的化合物有两性 | |
| C. | Q是硫元素 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com