
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料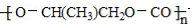 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
分析 A.聚丙烯的结构简式为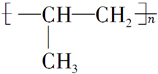 ;
;
B.凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体;
C.凡链节中主碳链只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
D.由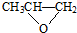 和 CO2在催化剂作用下加聚反应生成全降解塑料
和 CO2在催化剂作用下加聚反应生成全降解塑料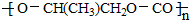 .
.
解答 解:A.丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: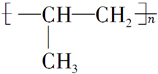 ,故A错误;
,故A错误;
B.CF2=CF2和CF2=CFCF3通过加聚反应制得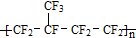 ,故B正确;
,故B正确;
C.合成高分子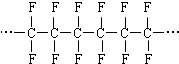 的单体是CF2=CF2,故C正确;
的单体是CF2=CF2,故C正确;
D.全降解塑料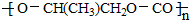 可由
可由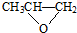 和 CO2在催化剂作用下加聚生成,故D正确;
和 CO2在催化剂作用下加聚生成,故D正确;
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,本题注意把握高聚物的单体的判断以及反应的特点,难度不大.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | Zn与稀H2SO4反应时,加入少量CuSO4可使反应加快 | |
| D. | KMnO4与H2C2O4反应时,加入少量MnSO4可使反应加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、硅、硫等元素在自然界中只存在化合态 | |
| B. | 纯铁的抗腐蚀性能比生铁好 | |
| C. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 | |
| D. | 制备FeCl3不能采用将其溶液直接蒸干的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻羟基苯甲酸与NaHCO3溶液反应 | |
| B. | 2-氯丁烷( )与NaOH的乙醇溶液共热 )与NaOH的乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
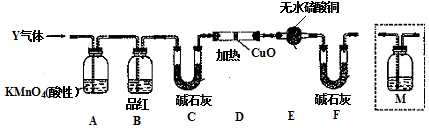
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com