
【题目】下列实验操作中错误的有
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底
C. 过滤时,玻璃棒下端在引流过程中应靠在三层滤纸处
D. 称量时,称量物放在纸上置于托盘天平左盘,砝码直接放在天平右盘
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】化学与生命健康密切相关,“84”消毒液(有效成分为 NaClO)在抗击新冠肺炎疫情中起到重要作用。下列说法错误的是
A.“84”消毒液为混合物
B.“84”消毒液具有漂白性
C.“84”消毒液可用于灭杀新型冠状病毒
D.“84”消毒液可以与“洁厕灵”(主要成分为盐酸)混用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量,某实验小组做了如下实验:铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO ![]() 被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO ![]() 被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
(1)滴定过程中,高锰酸钾应盛装在滴定管中(填“酸式”或“碱式”).
(2)用离子方程式表示步骤二中涉及到的相关化学反应:;Zn+2Fe3+═2Fe2++Zn2+ .
(3)步骤三中滴定终点的判定: .
(4)在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量 . 在步骤三中,若滴定前仰视读数,滴定后俯视读数,则测得的铁含量 . (选填“偏低”、“偏高”、“不变”)
(5)实验测得该晶体中铁的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文房四宝即笔、墨、纸、砚,其中以湖笔、徽墨、宣纸和端砚最为称著。下列说法正确的是
A.徽墨中墨的主要成分是黑色的油脂B.湖笔中笔头的羊毫的主要成分是蛋白质
C.宣纸的主要成分是无机碳和少量的纤维素D.含较多氧化铁的端砚呈黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制一定物质的量浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A. ①②③④B. ②③C. ①②④D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________。
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是________________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________。
Ⅱ.为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
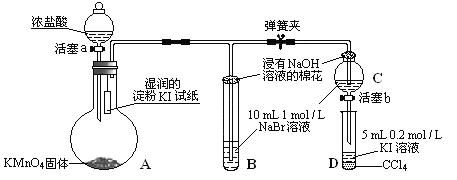
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(1)A中发生反应生成氯气,请写出该反应的离子方程式:___________________。
(2)验证氯气的氧化性强于碘的实验现象是________________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________。
(4)为验证溴的氧化性强于碘,过程④的操作和现象是______________________。
(5)过程③实验的目的是____________________。
(6)请运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在①~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),⑤所对应元素的单质工业制备方法为 。
(3)用电子式表示元素③与⑧形成化合物的过程 。
(4)我国首创以单质⑤—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极反应是 ,正极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等
B.平衡时,两个容器中NH3 的体积分数均为1/8
C.容器②中达平衡时放出的热量Q=4.63 kJ
D.若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族;E的单质为黄色晶体,易溶入CS2
(1)请写出元素符号:B;C;
(2)画出E的阴离子结构示意图:;
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为;
(4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L的NaOH溶液中,完全吸收后,溶液中(除Na+外)浓度最大的离子是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com