
�ں����ܱ�����ͨ�����ʵ���Ũ�Ⱦ�0.1 mol��L��1��CH4��CO2����һ�������·�����Ӧ��CO2(g)��CH4(g)  2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ�������й�˵��һ����ȷ����
2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ�������й�˵��һ����ȷ���� 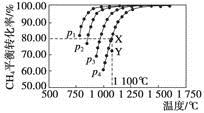
| A��������Ӧ�Ħ�H��0 |
| B��ѹǿp1��p2��p3��p4 |
| C��1 100 ��÷�Ӧ��ƽ�ⳣ��Ϊ64 |
| D��ѹǿΪp4ʱ����Y�㣺v(��)��v(��) |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
mA(g)+nB(g)  pC(g)+qQ(g)��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־�ǣ� ��
pC(g)+qQ(g)��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־�ǣ� ��
����ϵ��ѹǿ���ٸı� �ھ�����ϵ���¶Ȳ��ٸı� �۸���ֵ�Ũ�Ȳ��ٸı�
�ܸ���ֵ������������ٸı� �ݷ�Ӧ����vA: vB: vC: vD��=��m:n:p:q
��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ
| A���ۢܢݢ� | B���ڢۢܢ� | C���٢ۢܢ� | D���٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶���,�ڹ̶��ݻ����ܱ������з������з�Ӧ:2HI(g) H2(g)+I2(g)����HIŨ����0.1 mol��L-1����0.07 mol��L-1ʱ,��Ҫ15 s,��ôHIŨ����0.07 mol��L-1����0.05 mol��L-1ʱ���跴Ӧ��ʱ��Ϊ
H2(g)+I2(g)����HIŨ����0.1 mol��L-1����0.07 mol��L-1ʱ,��Ҫ15 s,��ôHIŨ����0.07 mol��L-1����0.05 mol��L-1ʱ���跴Ӧ��ʱ��Ϊ
| A������5 s | B������10 s | C������10 s | D����10 s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦmA(g)��nB pC(g)��qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ����
pC(g)��qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ����
A��������B������ƽ����ϵ��ɫ���˵��B��������
B������ѹǿ��ƽ�ⲻ�ƶ���˵��m��nһ������p��q
C�������¶ȣ�A��ת���ʼ�С��˵������Ӧ�����ȷ�Ӧ
D����B�����壬����A������A��B��ת���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼ�ǿ��淴ӦX2 + 3Y2 2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ��ԣ���ʱ�䣨t���Ĺ�ϵ���ߣ�
2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ��ԣ���ʱ�䣨t���Ĺ�ϵ���ߣ�
����������ȷ����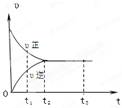
| A��t1ʱ��ֻ��������Ӧ | B��t2ʱ����Ӧ������ |
| C��t2~ t3����Ӧ���ٷ��� | D��t2~t3�������ʵ�Ũ��һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ʵ����ʵ���������Ӧ���۲���ȷ���ǣ�
| ѡ�� | ʵ �� �� ʵ | �� �� |
| A | �����������䣬 0.01mol/L��KMnO4������Һ�ֱ���0.1mol/L��H2C2O4��Һ��0.2mol/L��H2C2O4��Һ��Ӧ��������ɫʱ��̡� | ��������������ʱ������Ӧ��Ũ�ȿ���ʹ��ѧ��Ӧ���ʼӿ� |
| B | �����������䣬�ֱ�����������ʵ���Ũ�ȵ�Na2S2O3��Һ��H2SO4���Һ������ˮ����ˮ�У�������ˮ�еĻ��Һ�ȳ��ֻ��ǡ� | ��������������ʱ����Ӧ��ϵ���¶�Խ�ߡ���ѧ��Ӧ����Խ�� |
| C | ������MnO2��ĩ����ʢ��10%˫��ˮ����ƿ�ڣ��ڻ�ѧ��Ӧǰ��MnO2�������ͻ�ѧ���ʶ�û�з����ı䡣 | ������Ȼ���Լӿ컯ѧ��Ӧ�����ʣ���һ�������뻯ѧ��Ӧ���� |
| D | һ�������£��ֱ����ݻ�Ϊ1L���ݻ�Ϊ2L�������ܱ������м�������������͵��������������·�Ӧ��H2(g)��I2(g) 2HI(g)����õ���HIʱ��Ҫ��ʱ��ǰ���١� 2HI(g)����õ���HIʱ��Ҫ��ʱ��ǰ���١� | ��������������ʱ����̬��Ӧ��ϵ��ѹǿԽ��ѧ��Ӧ����Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A(g)+xB(g) 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ���±���ʾ������˵����ȷ����
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ���±���ʾ������˵����ȷ����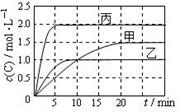
| ���� | �� | �� | �� |
| �ݻ� | 0.5L | 0.5L | 1.0L |
| �¶�/�� | T1 | T2 | T2 |
| ��Ӧ�� ��ʼ�� | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
t ��ʱ�������������ܱ������з�����Ӧ��X(g)+3Y(g)  2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±���
2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±���
| ���� | X | Y | Z |
| ��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
| 2 minĩŨ��/mol��L-1 | 0.08 | a | b |
| ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Կ��淴ӦN2��g��+3H2��g�� 2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
| A���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ����2x mol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ������������СΪԭ����һ�룬���´ﵽƽ���c��NH3����Ϊԭƽ��ʱ��2�� |
| D�����ﵽƽ��ʱ�����ų�46.2kJ����������l mo1NH3��g������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com