
| A.微粒半径:K+>Na+>Al3+>Cl- |
| B.氢化物的稳定性:HCl>H2S>PH3>SiH4 |
| C.酸性:H2SO4>H3PO4>H2CO3>HClO |
| D.金属性:Be<Mg<Ca<K |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.All4与ⅡA族元素性质相似 |
| B.Al13、Al14互为同位素 |
| C.Al13和Al14都具有强还原性,容易失去电子生成阳离子 |
| D.Al13超原子中Al原子间是通过离子键结合的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若A原子的最外层电子数比电子层数少1,则C的一种氧化物可以使品红溶液褪色 |
| B.若A的单质能与无水乙醇反应,则B的氧化物一定为酸性氧化物 |
| C.若A的氧化物为酸性氧化物,则B的最高价氧化物的水化物为强酸 |
| D.若A的氧化物可以与强酸、强碱反应,则氢化物的熔沸点C比B高 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.每一周期元素都是从碱金属开始,以稀有气体结束 |
| B.f区都是副族元素,s区和p区的都是主族元素 |
| C.已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol |
| D.Ge的电负性为1.8,则其是典型的非金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,硫为浅黄色固体,而氯为黄绿色气体 |
| B.跟金属反应和氢气反应时,硫被还原为-2价,氯被还原为-1价 |
| C.硫不溶于水而氯气能溶于水 |
| D.跟同一种金属(如Fe或Cu)反应时,金属被硫氧化成低价态,被氯氧化成高价态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径大小:Na>S>O |
| B.金属性强弱:K>Na>Ca |
| C.酸性强弱:HIO4>HBrO4>HClO4 |
| D.碱性强弱:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
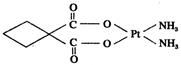
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
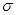 键 G.
键 G.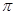 键
键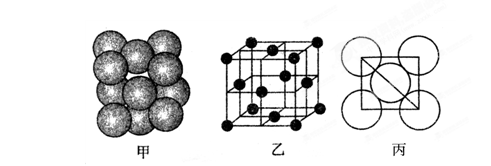
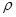 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com