
分析 (1)根据n=$\frac{m}{M}$,V=nVm可知,相同条件下,质量相同时,气体的相对分子质量越小,气体所占体积越大;
(2)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多;C元素质量分数越大生成二氧化碳越多;
(3)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则反应前后气体总化学计量数不变,据此计算判断.
解答 解:(1)CH4、C3H4、C2H4、C2H6、C3H6的相对分子质量大小为:CH4<C2H4<C2H6<C3H4<C3H6,根据n=$\frac{m}{M}$,V=nVm可知,相同条件下,质量相同时,气体的相对分子质量越小,气体所占体积越大,故质量相同时,在相同状况下体积最大的是CH4,
故答案为:CH4;
(2)CH4、C3H4、C2H4、C2H6、C3H6的C%大小为:CH4<C2H6<C3H8<C2H4<C2H2,质量相同时,分子中C元素的质量分数越大,完全燃烧时生成CO2越多,故完全燃烧生成CO2最多的是C2H2;故答案为:C2H2;
(3)120℃条件下水为气体,燃烧通式燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,故y=4,即CH4、C3H4、C2H4完全燃烧后体积不变,
故答案为:CH4、C3H4、C2H4.
点评 本题考查烃燃烧耗氧量、生成二氧化碳与水的量问题,难度不大,注意对规律的理解与掌握.


科目:高中化学 来源: 题型:解答题
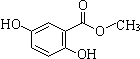
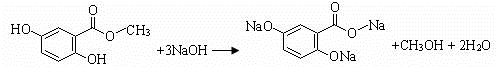 .(不用写反应条件)
.(不用写反应条件)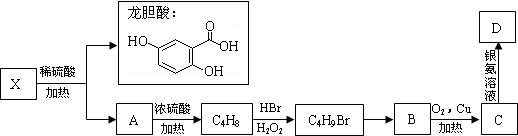
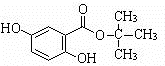 .
.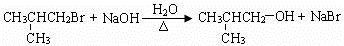 .(用结构简式表示)
.(用结构简式表示)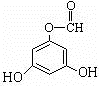 或
或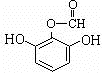 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用粉末状或小颗粒状固体 | |
| B. | 用胶头滴管滴加少量液体 | |
| C. | 给盛有2/3体积液体的试管加热 | |
| D. | 过滤时漏斗的下端管口要紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.
人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(k) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com