
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:2016-2017学年河北冀州市高二上开学调研化学卷(解析版) 题型:选择题
对于平衡体系:mA(g)+ nB(g) pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二下期末考化学(解析版) 题型:填空题
(10分)常温下向25 mL盐酸中逐滴滴入0.1 mol·L-1氨水,溶液中由水电离出的H +浓度c水(H+)随滴入氨水的体积变化如图所示。
+浓度c水(H+)随滴入氨水的体积变化如图所示。

(1)盐酸的浓度为________________;V1的值为________________。
(2)B点和D点溶液中的溶质分别是__________、________________(填化学式)。
(3)在V(NH3·H2O)从0到V2 mL的变化过程中,溶液中不可能出现的离子浓度排序是______(填字母)。
A.c(Cl-)>c(NH)>c(H+)>c(OH-)
B.c(NH)>c(Cl-)>c(H+)>c(OH-)
C.c(NH)>c(Cl-)>c(OH-)>c(H+)
D.c(H+)>c(Cl-)>c(NH)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二下期末考化学(解析版) 题型:选择题
关于0.1 mol·L-1NaHCO3溶液,下列说法正确的是( )
A.溶质水解反应:HCO+H2O?=?H3O++CO
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO)
C.微粒浓度关系:c(Na+)>c(HCO)>c(H2CO3)>c(CO)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二下期末考化学(解析版) 题型:选择题
①加入氯水振荡,观察水是否有红棕色的溴出现 ②滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 ③加入NaOH溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 ④加入NaOH的醇溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成( )
A. ①③ B. ②④
C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南文昌中学高二下学期期末考试化学卷(解析版) 题型:选择题
有机物A的结构如下图所示,下列说法正确的是( )
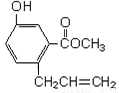
A.一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2
B.一定条件下,1 mol A能和5 mol氢气发生加成反应
C.一定条件下,1 mol A能与3 mol NaOH反应
D.A能与碳酸氢钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江第一高级中学高三上开学摸底考试化学(解析版) 题型:实验题
(19分)Ⅰ.实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaCl g,应用10mL量筒量取H2SO4 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓H2SO4时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
H、容量瓶加水定容时俯视刻度线
Ⅱ.为了测定已部分变质的过氧化钠样品的纯度(质量百分含量),设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中。按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有________个为氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”),打开______(填“K1”、“K2”或“K3”)。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是__________,需缓缓打开K1的原因为 。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是 (用含x、y的式子表示,上述体积均已折算成标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com